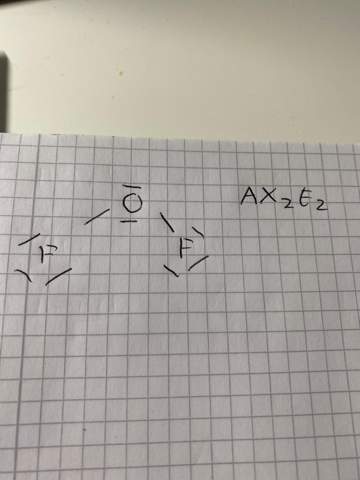
Warum hat OF2 zwei freie Elektronenpaare?
Ich versteh nicht wieso das Sauerstoffdifluorid im EPA- Modell den Molekültyp AX2E2 hat
also AX2 macht ja für mich Sinn, weil das Zentralatom, in dem Fall Sauerstoff, zwei Bindungspartner hat (Fluor)
aber wieso 2 freie Elektronenpaare?
was meint man mit freie Elektronenpaare?
beziehen sich die zwei freien Elektronenpaare immer auf das Zentralatom oder wie
ja verstehst leider nicht, würde mich über eine Antwort freuen;)
1 Antwort
Damit sind die zwei nichtbindenen Paare am Sauerstoff gemeint. Sauerstoff hat sechs Valenzelektronen, zwei davon bilden zwei normale Einfachbindungen zum Fluor aus, und die verbleibenden vier bilden diese beiden Paare.
Letztlich ist das nicht anders als beim H₂O, das ja auch (und zwar aus demselben Grund) zwei einsame Paare hat, also zum Typ AX₂E₂ gehört.