Reihenfolge Basizität : primäres, sekundär und tertiäres Amin?
Welches amin ist am meisten basischund welches am wenigsten und warum ?
2 Antworten
Bei primären Aminen ist das Stickstoff Atom an ein C-Atom gebunden, bei sekundären an zwei und tertiären an drei C-Atome.
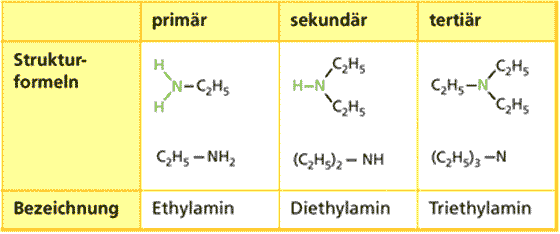
Die basische Wirkung von Aminen ergibt sich aus dem freien Elektronenpaar am Stickstoff über das ein Proton gebunden werden kann.
Die Alkylreste (die C-Atome mit allem was dranhängt) haben einen elektronenschiebenden Effekt (+I Effekt) und erhöhen dadurch die Elektronendichte am N-Atom wodurch dieses leichter Protoniert werden kann.
Damit gilt grundsätzlich für die Basizität:
Primär < Sekundär < Tertiär
Allerdings spielt in wässriger Lösung auch der Hydratisierungsgrad eine Rolle. In der Realität ist die Reihenfolge daher meist eher:
Tertiär < Primär < Sekundär
Allerdings gilt diese Reihung nur innerhalb einer Klasse (in diesem Fall aliphatische Amine). Je nach Substituenten kann die Basizität sehr unterschiedlich sein.

In Bezug auf die Basizität von Aminen kann man sie in primäre, sekundäre und tertiäre Aminen unterteilen.
- Primäre Amine haben einen freien Stickstoffatom in ihrer Molekülstruktur, was sie zu den am stärksten basischen Verbindungen macht.
- Sekundäre Amine haben ein Stickstoffatom, das an ein Kohlenstoffatom gebunden ist. Sie sind etwas weniger basisch als primäre Amine, aber immer noch recht basisch.
- Tertiäre Amine haben ein Stickstoffatom, das an zwei Kohlenstoffatome gebunden ist. Sie sind am wenigsten basisch von allen Amine, da sie keine freien Stickstoffatome haben.
Daher ist das primäre Amin am meisten basisch und das tertiäre Amin am wenigsten basisch, da sie die meisten und wenigsten freien Stickstoffatome haben.