Oxidationszahlen richtig bestimmt? Chemie!
Also habe wieder eine kleine Übung gemacht und jetzt möchte ich halt wissen ob meine Ergebnisse okay sind und was ich falsch gemacht habe. Leider habe ich in meinem Buch dazu keine Lösungen :( Wäre nett wenn mir jemand hilft.
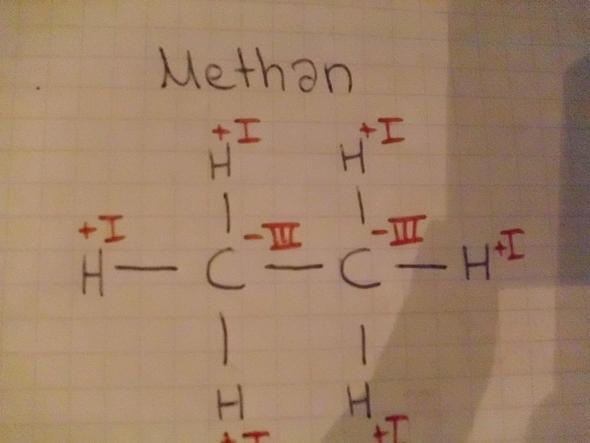
- Das erste Bild ist Methan.
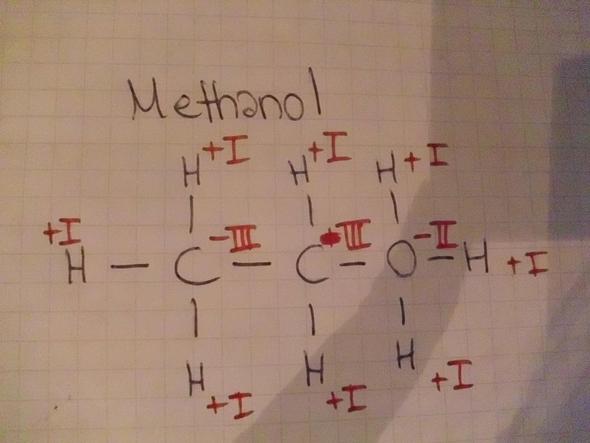
- Das zweite Methanol.
- 1-Propanol
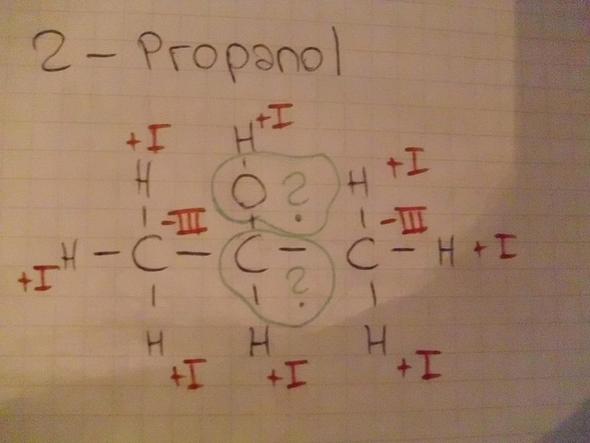
- 2-Propanol (Ich hatte dort Probleme mit der Bestimmung der Oxidationszahlen an der funktionellen Gruppe)
- Propanon( Ebenfalls das gleiche Problem wiebei 2-Propanol-Ich sehe gerade, dass das Bild doof geworden ist.Also wäre echt nett wenn jemand hier mir die Oxidationszahlen ab der funktionellen Gruppe sagen würde]
Ich freu mich über jede Hilfe :)
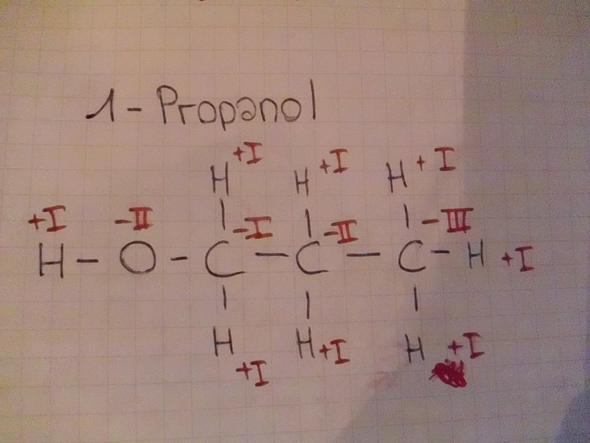
8 Antworten
Ich hab ja schon mal ein verblüffend einfaches Kochrezept beschrieben: guckst du im Periodensystem die Elektronegativitäten der Atome nach.
Dann schreibst du zu jeder einzelnen Bindung (bei Doppelbindungen also zweimal) -1 (minus eins) zum Atom mit der größeren und +1 zum Atom mit der kleineren EN. Bei gleich starken zweimal die Null.
Wenn du damit fertig bist, stehen bei jedem C 4 Zahlen, bei jedem O 2 Zahlen (entsprechend der Wertigkeit).
Zahlen addieren; fertig.
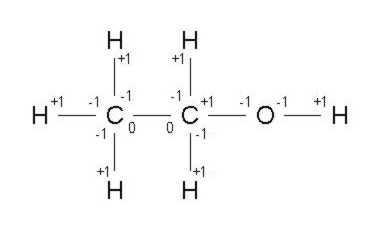
Ich hab 'n Ethanol-Bild angefügt; hoffe es klappt. Resultat: Wasserstoff jeweils +1 (leicht zu addieren), Sauerstoff -2, Kohlenstoff einmal -3 und einmal -1.
Und übrigens: Methan und Methanol haben nur ein C.
Danke für den Tipp :) Der wird sehr hilfreich sein in während meiner Prüfung :)
Bei 2-Propanol ist die Oxidationszahl von Sauerstoff -2 und die vom Kohlenstoff Null. Alle anderen Oxidationsstufen sind formal richtig eingetragen.
Die Oxidationszahlen sind immer nur formale Werte, da die tatsächliche Ladungsverschiebung (Polarisierung) sehr komplex ist und meist schwer zu ermitteln. Zudem treten immer wieder im Molekül Ladungs-Fluktuationen auf, so dass nur von statistischen Werte gesprochen werden kann. -- Bezogen auf dein Problem mit der Oxidationsstufe Null ist zu sagen, dass sie durchaus immer wieder anzutreffen ist, so z.B. in dem sehr einfachen Molekül 'Formaldehyd' H2C=O.
Ich muss noch an meine Antwort anfügen, dass Molekül 1 kein Methan, sondern ein Ethan ist und das Molekül 2 nicht existent ist, weil Sauerstoff gegenüber Wasserstoff immer elekrtronegativ ist und folglich nur zwei Bindungen ausbilden kann.
Ja,dass habe ich auch schon bemerkt :) Das heißt für mich nochmal die homologe Reihe wiederholen :D Danke für den Hinweiß :)
NEIN!
Zum einen hat Methan nur ein C, keine 2 (Bild 1). Ebenso Methanol.
Zum anderen hat ein O in der Regel 2 Bindungen und nicht 4 (Bild 2).
Bild 3 scheint ok.
Bild 4: Das mittlere C hat 0, Sauerstoff wie fast immer -2.
Kleiner Tipp: Die Summe aller Oxidationszahlen in einem neutralen Molekül ergibt 0.
Das mit dem Methan ist mir jetzt auch schon aufgefallen :D Trotzdem Danke :)
Zu Bild 3: Wie geht das,dass ein Stoff die Oxidationszahl 0 haben kann?Ich dachte das geht nur,wenn man zwei Atome des gleichen Elementes in einer Bindung hat?
Das geht genauso, wenn die Elektronegativität des Atoms zwischen den Elektronegativitäten der zwei Atome liegt, mit denen es verbunden ist
Vom einen bekommt es +1, vom anderen -1, ergibt zusammen 0.
- Stimmt bis auf den falschen Namen
- Die Struktur ist falsch
- Stimmt
- Der mittlere Kohlenstoff hat Oxidationsstufe Null, das folgt eigentich ganz normal aus den Regeln (er hat je ein Elektron von seinen C-Nachbarn, und zwe aus der CH-Bindung, also gleich viel wie im Neutralen Atom). Der Sauerstoff natürlich −II.
Hmm..aber es gilt doch,dass nur Atome welche in einer Bindung mit einem Atom des gleichen Elementes die Oxidationszahl 0 haben können =(? So steht es jedenfalls in meinem Buch. Oder ist das in diesem Fall eine seltene Ausnahme?