Ist Hydrazin ein Dipol Molekül?
3 Antworten
Ja, allerdings ist nicht ganz leicht zu sehen, warum. Zwar ist die N–H-Bindung natürlich per se einmal polar, aber die Struktur von Hydrazin ist ein bißchen unintuitiv.
Bekanntlich kann man sich die Struktur von NH₃ vorstellen als die von einem CH₄, dem ein H fehlt (und natürlich ersetzt man gedanklich C durch N). Entsprechend kann man auch die Struktur von Hydrazin aus der des Ethans ableiten, indem man jedem der C-Atome ein H wegnimmt (genauer gesagt, durch ein einsames Elektronenpaar ersetzt). Aber jetzt gibt es zwei Möglichkeiten:
- Man kann die zwei H-Atome so wählen, daß sie einander gegenüber liegen. Dann erhält man eine symmetrische Struktur, die kein Dipolmoment haben kann.
- Oder man nimmt zwei zueinander schief stehende H-Atome, dann bekommt man eine unsymmetrische Struktur mit Dipolmoment, und das ist die richtige.
Das sieht dann ungefähr so aus, als ob die 2 N-Atome mit zwei H-Atomen in einer Ebene liegen, und die anderen beiden H-Atome stehen auf derselben Seite dieser Ebene, und der Dipolmomentvektor steht normal auf diese Ebene:
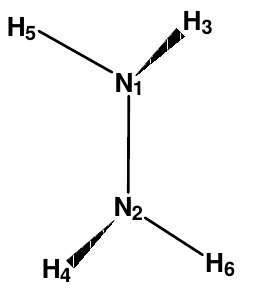
Jawollja!
Die N-H Bindung ist polar und die Molekülstruktur nach dem VSEPR-Modell ist trigonal-pyramidal; d.h. die Ladungs-Schwerpunkte fallen nicht zusammen und somit ergibt sich ein permanenter Dipol.
Ja., gem. https://en.wikipedia.org/wiki/Hydrazine in der Stärke von Wasser.