Einstellung von 1 molarer NaOH mit HCl
Hallo ihr Lieben,
ich hab eine Frage zur Einstellung von NaOH. Ich habe viele verschiedene Möglichkeiten gehört und bin jetzt etwas verwirrt. Wir haben es gegen Salzsäure der gleichen Molarität titriert, mit dem entsprechenden Indikator. Ich bin mir aber sicher das wir es in der Ausbildung (Chemielaborant) erhitzen mussten und gegen 2 verschiedene Indikatoren eingestellt haben. Ich musste es jetzt ewig nicht mehr machen. Meine Kollegin meinte das die es nur titiert haben ohne erhitzen und nur mit einen Indikator. Kann mir jemand sagen was die richtige Variante ist?
3 Antworten
Hi, das Proble mit der NaOH-Lösung ist, dass sich in Wasser immer ein gewisser Teil Kohlendioxid löst (in Form von Kohlensäure) und damit den pH-Wert beeinflusst. Bei einer Titration ist ja dein Ziel, die Ausgangskonzentration der Natronlauge sehr genau zu kennen. Da du aber nicht weißt, wie viel CO2 darin gelöst ist wird das Wasser, mit dem du die Natronlauge herstellen willst vor dem Lösen des Natriumhydroxid kurz aufgekocht, da dadurch die Kohlensäure zerfällt und Kohlenstoffdioxid ausgast. (Die Natronlauge später zu erhitzen wäre fatal, da dann Wasser verdampft und deine Konzentration nichtmehr bestimmbar ist)
Das mit den Indikatoren verstehe ich jetzt nicht so ganz. Einer reicht da eigentlich völlig aus (es muss halt der richtige sein, bei starke Säure mit starker Lauge ein Umschlagspunkt bei pH=7). Natürlich kannst du mehrere Indikatoren ausprobieren und dir die verschiedenen Umschlagpunkte anschauen.
Hoffe ich konnte dir helfen,
lG Chris
Wäre auch eine Möglichkeit, die Frage war etwas seltsam formuliert
Erhitzt haben wir wegen den carbonatgehalt in der Natriumhydroxid-Lösung.
Das ist vielleicht mit Indikatoren nötig, aber mit einer pH-Elektrode stört das Carbonat nicht wirklich.
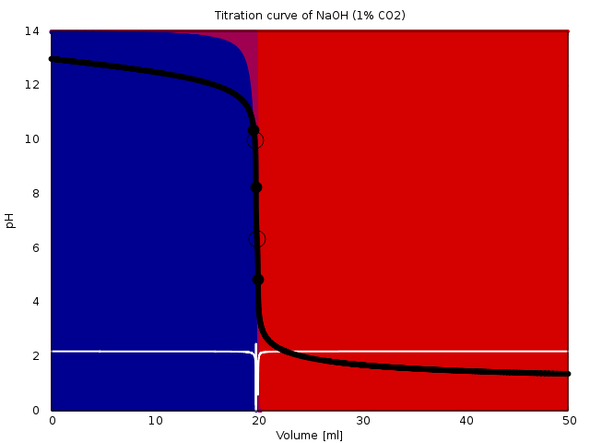
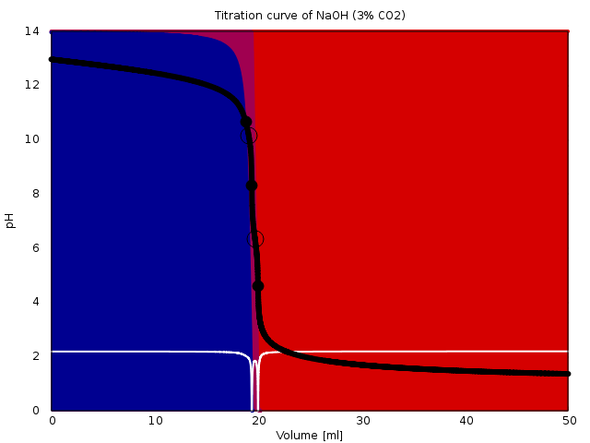
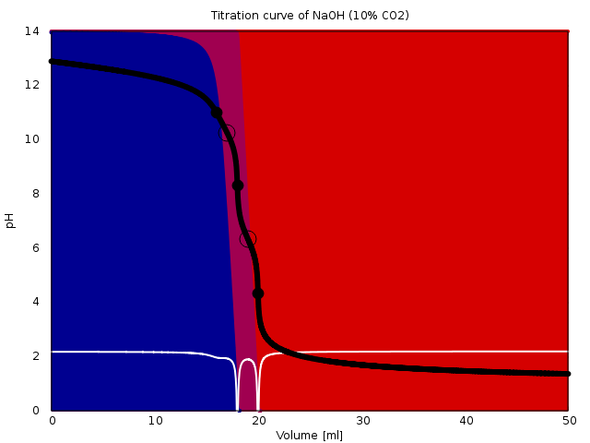
Zum Beweis lege ich drei (gerechnete) Titrationskurven bei. Alle sind 20 ml 0.1 mol/l NaOH mit 0.1 mol/l HCl. Im ersten Fall enthält sie auch 0.001 mol/l CO₂ (also 1% des NaOH), im zweiten Fall 0.003 mol/l und im dritten 0.01 mol/l (oder 10% der NaOH). In jedem Fall siehst Du die Titrationskurve, die Speziesverteilung während der Titration (Hintergrundfarben) und die erste Ableitung der Titrationskurve (weiß). Der Äquivalenzpunkt sollte in jedem Fall bei 20 ml liegen.
Und das tut er auch. Je nachCarbonatkontamination sieht man mehr oder minder deutlich einen vorgelagerten ersten Äquivalenzpunkt, der natürlich zu ignorieren ist. Der zeigt ja nur an, daß das NaOH aufgebraucht ist und es jetzt dem Carbonat an den Kragen geht. Grob zwischen dem ersten und dem zweiten Äquivalenzpunkt hast Du Hydrogencarbonat in der Lösung.
Bei 1% Carbonatlast liegt dieser erste Wendepunkt der Titrationskurve nur 0.2 ml vor dem echten ÄP und ist kaum zu sehen. Die erste Ableitung der Titrationskurve hat zwar kein Problem, das aufzutrennen., aber Ich weiß nicht, was Dein experimentelles Equipment kann, möglicherweise beißt es da ein bißchen in die Kante. Bei 1% dürfte wohl das Limit in der Genauigkeit erreicht sein.
Bei stärkerer Beimengung von CO₂ sieht die Kurve zwar ein bißchen schräg aus, aber die Auswertung sollte kein Problem machen, weil man das gut auftrennen kann.
(Hat etwas länger gedauert, weil eine von den Kurven nicht konvergieren wollte)
Ich bin schon etwas erstaunt, wie wenig professionell die meisten Vorschläge in diesem Forum sind. Um den Titer von Natronlauge präzise einzustellen, muss man zuvor die Salzsäure einstellen, dazu ist wasserfreies und nochmals getrocknetes Natriumcarbonat als** Urtitersubstanz** erforderlich, das in CO2-freiem Wasser (daher "Kochen") gelöst wird. Die beiden Idikatoren sind Phenolphthalein und Methylorange für die beiden Farbumschläge. Nähere Details finden Sie sicher in Ihren Berichtsheften, zu deren Führung Ihr Ausbilder Sie sicher angehalten hat.
Was wirklich das gemeint war, dann geht das aus der Frage kaum hervor, zumindest ohne telepathische Fähigkeiten beim Leser.
Meine Kollegin meinte das die es nur titiert haben ohne erhitzen
Die natürlichste Erklärung für diesen Satz ist es wohl, daß in der Hitze titriert wurde. Finde ich.
Ich habe das so aufgefaßt, daß er in der Hitze titriert hat, um CO₂ aus der Titrationslösung auszutreiben. Sobald man es in den Titrationskolben pipettiert hat, spielt die Konzentration ja keine Rolle mehr. Meine Annahme war, daß die NaOH schwer carbonatverunreinigt ist und das Carbonat einfach der NaOH-Konzentration zugeschlagen werden soll.