Chemische Reaktionen - warum irreversibel?
Schreibe morgen Biochemie und hab in einer Altklausur folgende Frage gefunden: Warum ist die Umwandlung von Pyruvat zu Acetyl-CoA durch Pyruvatdehydrogenase irreversibel?
Ich fühl mich da echt überfragt.. Wann sind denn Reaktionen allgemein irreversibel? Woran erkennt man es?
Die Reaktionsgleichung ist ja die:
Pyruvat + HS-CoA + NAD+ --> Acetyl-CoA + CO_2 + NADH + H+
Wird das NADH +H+ vielleicht gleich "weggebracht" und es kann deshalb kein Pyruvat mehr entstehen?
6 Antworten

Oder weil vielleicht das CO2 beiseite gebracht wird?!?


Machst du dich grad lustig, oder einfach nur spass? Die Antwort von Brevian ist durchaus plausibel (auch wenn es meiner Meinung nach dsa Acetyl-CoA ist dass quasi "beiseite gebracht wird"). --> Nimm die gleich Produkte weg, dann kann die gegenreaktion auch nicht ablaufen.

danke.. das war so naheliegend, dass es einfach nicht stimmen konnte xD naja, wurde heute sowieso nicht abgefragt ein glück

Machst du dich grad lustig, oder einfach nur spass?
Ja. Und ich bin mir sicher, daß Bevarian es richtig einordnen kann.

Das könnte themodynamische (Enthalpie) oder kinetische (Aktivierungsenergie) Gründe haben. Oder es ist einfach zu unwahrscheinlich, dass die dann drei Edukte gleichzeitig zusammentreffen (CO2, Enzym, Essigsäure) (die Bindung an das CoA ist ein Extraschritt).

In der Chemie sind prinzipiell alle Reaktion erstmal reversibel. Aber verschiedene Faktoren können die Rückreaktion so unwahrscheinlich machen, dass sie als irreversibel angesehen werden können.
Thermodynamische Gründe - Beispiel Natrium + Chlor zu Natriumchlorid [Kochsalz]. Bei der Reaktion wird sehr viel Energie frei. Im gegenzug müsste ebensoviel Energie eingesetzt werden um die Rückreaktion ablaufen zu lassen. Was gerade bei Salzens ehr unwahrscheinlich, aber möglich ist.
Kinetische Gründe - [fehlt mir gerade ein gutes beispiel] D.h. die benötigte gesamtenergie für den Vorgang ist nicht so hoch eine Rückreaktion zu verhindern. Aber unterschiedliche faktoren erhöhen die Aktivierungsenergi so stark, dass die reaktion garnicht erst startet. z.B. weil ein für die reaktion benötigter Katalysator fehlt.
Sonstige Gründe die eine Gleichgewichtsreaktion beeinflussen. Typisch nach dem Prinzip von le Chatelier. Ganz klarer favourit ist hier das wegfallen eines Produktes. Wenn ein Produkt der Reaktion aus dem Systme verschwindet (egal ob es weiterreagiert, aus einer Lösung ausfällt oder ausgast oder anderweitig nicht mehr zur verfügung steht) kann die Rückreaktion natürlich auch nicht stattfinden. ;)
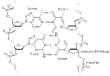
Das enzym katalysiert nur in eine richtung. außerdem reicht das energetische potential nichtmehr aus, da h+ ionen schon abgegeben wurden, der stoff also nicht wieder aufgebaut werden kann.
(google mal wirkungsspezifität von enzymen)
der nächste schritt wäre übrigens der weitere abbau zu citrat.
gruß km :)

Wirkungspezifität von enzymen hin oder her. Auch bei Katalysatoren können die Reaktionen prinzipiell in beide Richtungen verlaufen

Simples Beispiel: Membranständige ATPasen. Diese können ATP zu ADP +P spalten und dabei Ionen aus der Zelle Pumpen. Genauso gut können aber auch Ionen durhc die ATPasen in die Gegenrichtung fliessen und dabei werden ADP+P zu ATP. Und sehr viele Stoffwechselreaktionen können mit ein und den selben Enzymen in die eine oder in die Gegenrichtung ablaufen. Je nach äusseren umständen
(Die Jeweiligen Konzentrationen der Produkte und der Edukte beeinflussen das chemische Gleichgewicht. Google das mal)

Google mal Enthalpie, Entropie, endo/exotherm, ener/exergonisch...

Die Begriffe kenn ich, nur weiß ich die Verbindung grade nicht zu meinem Problem.

Nichts will von sich aus in einen geordneteren/ energiereicheren Zustand. Kuck dir im Zweifelsfall die Enthalpien und Entropien (Formelsammlung, Wikipedia &c.) an...

Dann wär doch so gut wie gar keine Reaktion reversibel. Das passiert doch durchaus, nur eben mit sehr viel geringeren Wahrscheinlichkeiten als die Reaktion in Richtung ungeordneter/energiearmer zustand

Viele Schritte der Glykolyse und des Citronensäure-cyklus sind reversibel, auch wenn das eine reaktion in einen energiereicheren Zustand bedeutet. (Dabei wird dann eventuell ATP gespalten statt gebildet)


Dementsprechend würd ich mich botanicus und Bevarian snchliessen, dass es damit zu tun haben könnte das die Produkte quasi sofort "wegreagieren " (-->an CoA gebunden werden)

@cartman In diesen Fällen mit Katalysator (Enzym) darauf spielt ja auch die Frage aus. Aber die meisten chemischen Reaktionen sind letzten Endes Gleichgewichtsreaktionen (Auch ohne Katalysator). Heisst die Wahrscheinlichkeit in Richtung Energiearm zu reagieren ist bei weitem höher, aber die gegenreaktion findet in geringem Maße auch statt. Kann man beeinflussen indem man die Produkte der (seltener Verlaufenden") Gegenreaktion an eine energetisch Günstigere Weiterführende Reaktion "koppelt". Damit kannst du dann das Reaktionsgleichgewicht verschieben. http://de.wikipedia.org/wiki/Chemisches_Gleichgewicht

...dann füge ich halt noch LeChatelier zu meinen Google-Vorschlägen hinzu...
Muß dafür ein Luftverschmutzungszertifikat gekauft werden? Oder darf dieses CO2 abgeschieden und unterirdisch eingelagert werden? Fragen über Fragen.