Chemie - Bohrsches Atommodell - Schalen
Hallo liebe Chemiker und Physiker! ;)
Beim lernen bin ich heute auf einige Probleme in der Chemie gestoßen. "Die äußerste Schale eines Atoms kann höchstens 8 Elektronen aufnehmen" - und wie sieht es mit dem Rest aus? Ich kann nicht verstehen wie die Verteilung auf die restlichen Schalen aussieht. Wieviele Schalen ein Atom hat kann man ja einfach im PSE nachschauen oder sich merken, aber woran sieht man die Verteilung auf die Schalen?
Danke für eure Hilfe;)
2 Antworten
Hey :)
Im Endeffekt hast du Recht. Aber: Die Elemente der Nebengruppen füllen die vorletzte Schale auf. Beispiel: Eisen.
Du hast auf der innersten Schale nur 2 Elektronen, weil die erste Periode nur zwei Hauptgruppen hat. Die zweite Schale hat acht Elektronen, weil sie acht Hauptgruppenelemente hat. Die dritte Schale hätte eigentlich 8 Elektronen, allerdings werden die 6 Elektronen von den Nebengruppen in diese Schale "gepackt". Die äußerste Schale hat hier zwei Elektronen, weil die Hauptgruppenelemente vor Eisen eben Kalium und Calcium sind.
Die Actinoide und Lanthanoide füllen die drittletzte Schale auf.
Bei Fragen melde dich :)
LG ShD
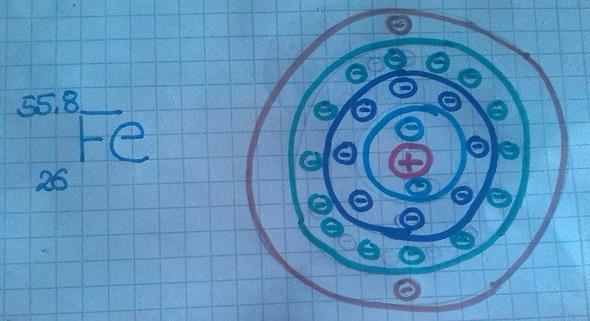
Ja, es hat vier Schalen. Es hat aber NICHT acht Außenelektronen! wer hat dir das erzählt? Es hat nur zwei Außenelektronen! Die Verteilung...wie erklärt man die am Besten:
- Auf der ersten Schale gibt es höchstens zwei Außenelektronen, auf der zweiten Außenschale höchstens acht.
- Die Anzahl der Außenelektronen hängt davon ab, das wievielte Hauptgruppenelement das Element ist. Nebengruppenelemente, Actinoide und Lanthanoide haben immer zwei Außenelektronen!
- Die Elektronen der Nebengruppenelemente füllen die vorletzte Schale auf.
- Die Elektronen der Actinoide und Lanthanoide füllen die drittletzte Schale auf.
Das heißt für Eisen:
- es hat vier Schalen, da es in der vierten Periode steht.
- Die ersten beiden Schallen sind vollständig, haben also zwei bzw. acht Elektronen.
- Die dritte Schale muss 14 Elektronen haben und nicht 8: Da Eisen das 6. Nebengruppenelement dieser Periode ist, sind diese sechs Elektronen zu diesen acht auf der vorletzten Schale zu ergänzen. Du kommst also auf 14 Elektronen in der vorletzten Schale.
- die letzte Schale, also die Außenschale, hat zwei Elektronen. Ds ist bei Nebengruppenelementen immer so.
Siehe hier, zu Eisen:
http://www.periodensystem.info/elemente/eisen/
LG ShD
Hat mir in der Schulaufgabe sehr geholfen ;) danke nochmal
Wow! Danke ;) so ausführlich haben wir das in der Schule nicht gemacht, da hies es einfach : die Nummer der Gruppe zeigt die ausenelemente. Bekommst den stern sobald ich kann ;)
Hier noch eine Adresse zu der Erklärung:
http://www.frustfrei-lernen.de/chemie/bohrsches-atommodell-chemie.html
Bei Fragen melde dich :)
LG ShD
Danke ;) werd's mir demnächst ansehen, schreiben am Donnerstag Chemie.
Ich hoffe du kannst mir helfen: Alles was ich über eisen (aus dem PSE) weis ist das es 4 Schalen (vierte Periode) und 8 ausenelektronen (achte Gruppe) besitzt. Wie kommst du auf den Rest? Ich verstehe die Verteilung einfach nicht da man scheinbar mehr Daten braucht.