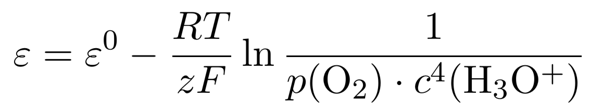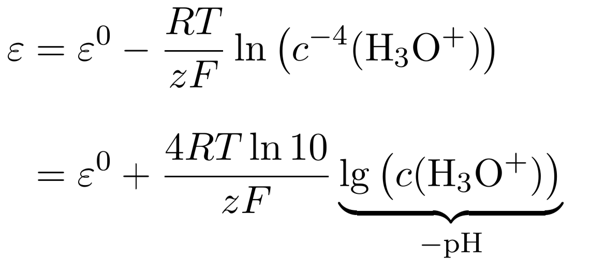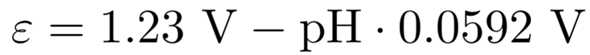Berechnung nach Nernst?
Das Standard-Potential des Redoxpaares 2 H2O / O2 + 4 H+ beträgt E0 = 1.22 V. Welchen Wert nimmt das Redoxpotential ungefähr in 1 molarer Natronlauge an? 0,4 V oder 0,8 V. Ich komme auf 1,22, da der Quotient ja 0 wird..
1 Antwort
O₂ + 4 H₃O⁺ + 4 e¯ ⟶ 6 H₂O
Diese Reduktionsreaktion hat ein Standardreduktionspotential ε⁰=+1.23 V, das gilt, wenn alle Substanzen im Standardzustand (1 bar, 1 mol/l, wäßrige Lösung, 25 °C etc.) vorliegen, also insbesondere c(H₃O⁺)=1 mol/l und daher pH=0.
Das Reduktionspotential bei anderen Konzentrationen kann man mit der Nernst-Gleichung ausrechnen, die in diesem Fall lautet
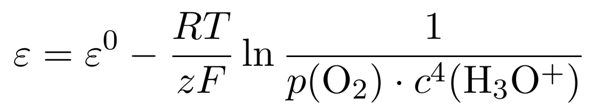
(das Wasser als Lösungsmittel wird natürlich ausgespart). Den Sauerstoff-Partialdruck wollen wir unverändert lassen, also können wir ihn auch streichen. Man könnte natürlich direkt einsetzen, aber wir wollen das ein bißchen weiter vereinfachen. Dazu nützen wir die Rechenregel log(aᵇ) = b⋅log(a) und rechnen außerdem den natürlichen auf den dekadischen Logarithmus um, damit wir direkt zum pH-Wert kommen:
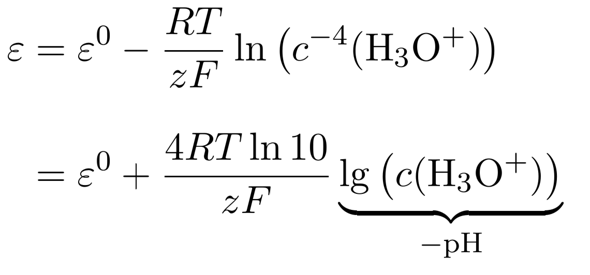
Der Vorfaktor vor dem logarithmischen Term besteht aus den Naturkonstanten R=8.3145 J mol¯¹ K¯¹ und F=96485 C/mol, dazu kommen noch T=298.15 K und z=4 (die Anzahl der umgesetzten Elektronen in der Reaktionsgleichung). Wenn man das alles einsetzt, bekommt man
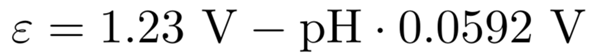
So können wir uns also das Potential für jeden pH ausrechnen; für pH=14 (einmolare Natronlauge) bekommt man ε=+0.40 V.