Bennenung der Atomorbitale?
Wie benennt man die Atomorbitale einzig mit einem PSE
4 Antworten
Schau dir das Bild an. Die hochstehenden Zahlen stehen für die Besetzung des jeweiligen Orbitals. Bei p2 ist bsw. das erste und das zweite p-Orbital mit jeweils einem Elektron besetzt.
Willst du nun also ein Element mithilfe des Orbitalmodells beschreiben, musst du alle gefüllten und teilweise besetzten Orbitale der Reihe nach aufschreiben.
z.B.: Stickstoff (N) = 1s^2 2s^2 2p^3
Für spätere Elemente kann man die vorangegangenen Edelgase als Abkürzung benutzen:
Stickstoff(N) = [He] 2s^2 2p^3
Schau dir das Video hier an, das könnte dir bei Orbitalen insgesamt helfen. Das Modell ist außerdem auf der folgenden Seite weiter erklärt:
https://www.youtube.com/watch?v=Pw-MeI_kK-0
http://www.seilnacht.com/Lexikon/pordn.htm
Hoffe, das hilft dir!
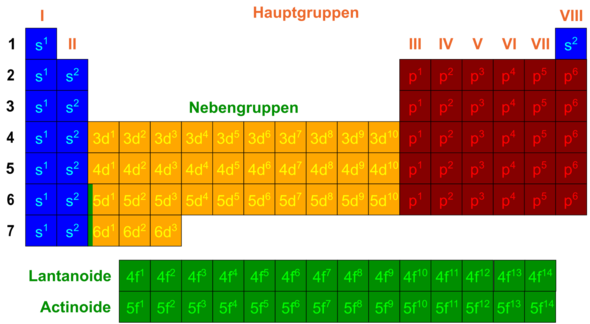
Dazu musst du schon verstehen, wie das PSE mit der Belegung der Atomorbitale zusammenhängt.
Und dazu musst zu vorher noch wissen, welche Orbitale es eigentlich gibt.
Und welches die Grundregeln der Belegungsreihenfolge sind.
Dann kannst du die Kleinigkeiten, die du vergessen hast, aus dem PSE ablesen.
Bis auf die ca. Ausnahmen, die es selbst du den komplzierteren Regeln gibt.
Nein, die 4s werden vor den 3d belegt, bei Kalium und Calcium.
Vielleicht war es auch nur ein Flüchtigkeitsfehler, denn die 3d kommen bei dir doppelt vor.
Aber jedenfalls kommen die 4f erst in der 6. Periode, also nach 6s und vor 5d, bis auf die Ausnahmen.
Ein Problembewusstsein scheinst du zu haben, jetzt musst du das Ganze noch (auswendig) lernen.
Aber auch zu diesen komplizierteren Regeln gibt es noch Ausnahmen, so ca. 10 Stück.
Und ich hab mir das nicht ausgedacht, ist halt so.
Wenn ich die Frage richtig verstanden habe:
Nach der Reihenfolge - Erst wird das 1s-Orbital gefüllt, dann das 2s, dann 2p usw. In die s-Orbitale gehen 2 Elektronen, in die p-Orbitale 6 Elektronen ...
Das heißt also:
*Wasserstoff: Ein Elektron im 1s-Orbital
*Helium: Zwei Elektronen im 1s-Orbital
*Lithium: Zwei Elektronen im 1s-Orbital und eins im 2s
Dabei schreibt man die Anzahl der Elektronen tiefgestellt dahinter.
Das ist soweit richtig, bis zum Argon.
Für 80 % der Elemente sind die Regeln etwas komplizierter, und selbst dazu gibt es Ausnahmen.
Im Übrigen wird die Anzahl zwar klein, aber hoch geschrieben.
Ach ja, das kommt davon, wenn man mitten in der Nacht Fragen beantwortet. Hochgestellt, natürlich hochgestellt. Unten kommt x/y/z hin, wenn man noch weiter aufspalten möchte.
Dann besteht z.B das 2p-Orbital aus 2px, 2py und 2pz, und die werden erst alle einfach belegt, bevor ein zweites Elektron mit antiparallelem Spin dazu darf usw - du hast ja völlig Recht!
Allerdings klang das für mich nach einer "Schulfrage" und in der Schule waren zumindest bei mir nur s und p Orbitale Thema. Klar wird das dann komplizierter, wenn man Nebengruppen und weitere Orbitalformen berücksichtigen muss, aber schön eins nach dem anderen :D
Wo du grad mal on bist, es gibt nicht das p-Orbital, sondern 3 davon, eben das px, py und pz.
Es gibt ja den Spruch " Man sollte die Dinge so einfach wie möglich darstellen, aber nicht einfacher".
Ich bin da eher Hardcore-Hardliner.
Und meine Antworten richten sich weniger an die 95 %, die ein klares Ja/Nein oder eine Formel brauchen, bis zur nächsten Prüfung.
Einige Fragesteller reagieren durchaus aufgeschlossen auf den Hinweis, dass ihr momentaner Stand nur vorläufig ist.
Bin ich der einzige, der lesen des Wortes "Atomorbital" total Bock auf eine Folge Star Trek TNG hat? :P
Ich denke schon.
Das ist halt ein Basisbegriff der Chemie.
Vielleicht hast du ADHS? Das "Android-Data-Hysterie-Syndrom".
Joa schon eigentlich, hilft mir aber iwi nicht gerade weiter :D
Wenn ich noch einmal nerven dürfte:
Die Orbitale werden immer gleich befühlt nach folgendem Muster:
1s 2s2p 3s3p3d 4s 3d 4p 5s 4d 5p 4f 5d
Nächste Frage: Wie kommt es zu den unterschiedlichen Oxidationszahlen der Nebengruppenelemente? Bzw was ist an deren Elektronenverteilung besonders
Danke im Vorraus!