Ammoniaksynthese Kc?
Ich muss bis Montag ein Referat über Ammoniaksynthese vorbereiten. Ich habe dazu schon Aufgaben bekommen. Allerdings heißt es in einer Aufgabe, ich soll Kc für die Ammoniaksynthese formulieren. Ich habe jedoch nichts gegeben. Woher weiß ich was für Konzentrationen ich einsetzten muss? Kc soll ich ohne den Einfluss der Faktoren wie Druck, Temperatur,... formulieren. Es soll also rein theoretisch sein und nicht wie es in echt ist. Wäre super, wenn mir jemand helfen kann ;)
2 Antworten
Also rein theoretisch wäre es so
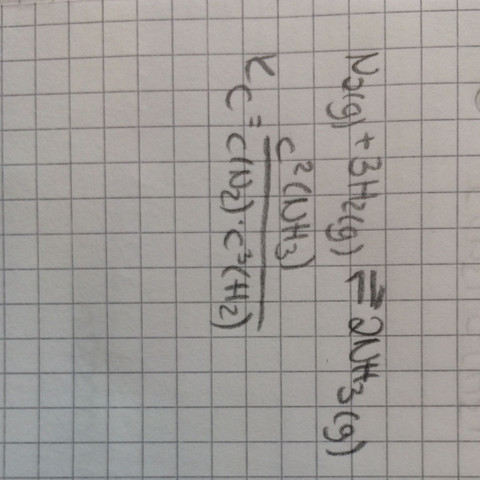
Da Du nur allgemein die Gleichung für Kc formulieren sollst, will ich Dir eine allgemeine Zusammenfassung für das MWG geben, und Du überträgst dies jetzt auf das Ammoniakgleichgewicht.
Für die Reaktion
a A + b B ⇌ d D + e E
ist das MWG (Massenwirkungsgesetz):
Kc = [c(D)ᵈ · c(E)ᵉ] : [c(A)ᵃ · c(B)ᵇ]
K gilt nur für eine bestimmte Temperatur bei einer bestimmten Gleichgewichtsreaktion. Die Einheit von K ergibt sich aus dem MWG.
Je größer K, desto mehr ist das Gleichgewicht auf die Produktseite verschoben. Wenn K < 1, dann liegt das Gleichgewicht auf der Eduktseite.