Wieso hat das Sauerstoff Molekül bei der Lewis Schreibweise diese Striche (siehe Bild)?
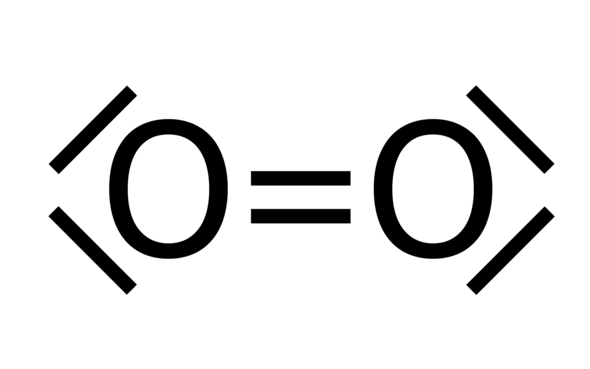
5 Antworten
Nun ja, von allen "bekannten" Molekülen ist das Sauerstoff-Molekül das einzige, das sich nicht durch eine Lewis-Formel darstellen lässt.
Also ist die Formel und das Bild falsch!
Oder ganz genau ist die Formel nur für eine sehr instabile und reaktive Form des O₂-Moleküls richtig, den Δ-Singulett-Sauerstoff, Lebensdauer lt. Wikipedia ca. 10⁻⁴ Sekunden.
Ich weiß nicht, wer es sagte, vielleicht Einstein, sicher nicht Konfusius:
Man sollte die Dinge so einfach wie möglich darstellen, aber nicht einfacher.
So leid mir's tut, schuld ist der, der dir so ein falsches Bild vor die Nase gehalten hat.
Normler Sauerstoff ist ein Radikal, genauer ein Diradikal, enthält also 2 ungepaarte Elektronen.
Noch schlimmer, als das nicht zu wissen, ist es, die Tatsache zu verleugnen.
Was ist so schlimm daran zu sagen
Den Sauerstoff behandeln wir in 3 Jahren?
Sauerstoff hat 6 Valenzelektronen, d.h. um die Edelgaskonfiguration zu erhalten brauch das Atom 2 weitere Elektronen. Und diese 2 Elektronen erhält es durch die Atombindung mit einem weiteren Sauerstoffatom.
Die äußeren Striche stellen die freien Elektronenpaare dar, die keine Bindung eingehen.
Ein Strich ist jeweils ein Elektronenpaar. Elektronen können nur einen Bindsungspartner haben, den jeweils anderen Pol. Dabei stoßen sie sich vom anderen Paar ab und es entsteht die Häusschenform
Weil Sauerstoff 6 Valenzelektronen hat und somit 2 zur Edelgaskonfiguration braucht. Daher die Doppelbindung.
Ist das nicht die Valenzstrich Sauerstoff Molekül Formel?