Wie kommt diese Redoxreaktion zustande?
Hey,
Ich habe aktuell In der Schule das Thema 'Erweiterte Redoxreaktionen', und unser Lehrer hat uns als Einführung diese Redoxreaktion gezeigt. Wichtig im Vorraus ist, dass diese Reaktion im sauren Milieu stattfindet.
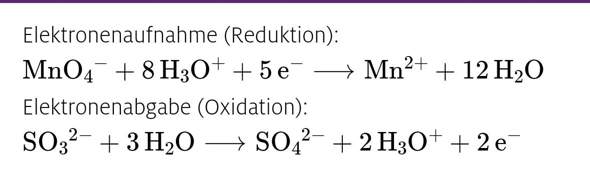
Erklärt wurde, dass die Elektronen durch die H3O+ Ionen ausgeglichen werden. Bei der Oxidation kann ich das nachvollziehen: 2 Elektronen werden mit 2 H3O+ ausgeglichen. Wie kommt es aber, dass bei der Reduktion 5 Elektronen mit 8 H3O+ ausgeglichen werden? Kann mir das jemand erklären?
Danke im Vorraus,
Louis
1 Antwort
Die H3O+ sind für den Ladungsausgleich. Du hast links 5 negative Ladungen von den Elektronen plus eine vom Permanganat MnO4^-. Insgesamt also -6. Die musst du jetzt auf dieselbe Ladung bringen, wie die rechte Seite deiner Gleichung. Da hast du 2+ vom Mangan-Kation. Du brauchst also links 8 H3O+ um auf die +2 zu kommen.
Wusste nicht, dass mit Ladungsausgleich der Ausgleich zwischen der linken und rechten Seite der Gleichung gemeint ist. Danke, jetzt hab ichs verstanden!