Wie funktioniert das aufstellen von Reaktionssymbolen für Redoxreaktionen?
Hey Leute,
ich bräuchte dringend Hilfe bei einer Hausaufgabe.
Ich weiß eigentlich gar nichts von dem Thema. Unser Lehrer hat uns das einfach als Hausaufgabe aufgegeben und wir sollten das lösen.
Es wäre echt lieb, wenn mir jemand von euch helfen könnte, da ich absolut keine Ahnung habe wie ich die Aufgaben lösen soll.
Geben Sie für die folgenden Verbindungen die Oxidationszahlen an. Kreuzen Sie an, ob es sich bei der jeweiligen Reaktion um eine Reduktion oder Oxidation handelt.
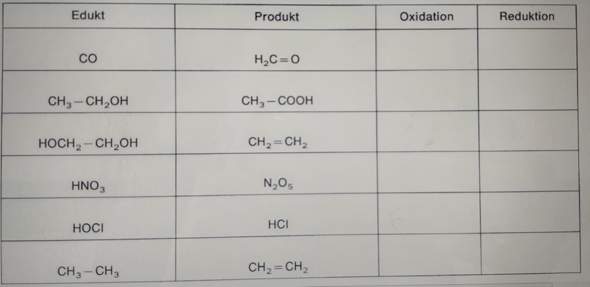
Vielen Dank schon mal im Vorraus :)
1 Antwort
Bei den Oxidationszahlen gelten normalerweise folgende Regeln:
- Sauerstoff O: -2
- Wasserstoff H: +1
- Die Summe der Oxidationszahlen einer Verbindung entspricht der Ladung der Verbindung
Bei der Oxidation erfolgt eine Elektronenabgabe, bei der Reduktion eine Elektronenaufnahme, was ablief kannst du ablesen indem du die Oxidationszahlen vor (Edukt) und nach (Produkt) der Reaktion vergleichst.
Beispiel Mg -> Mg2+ +2e- .Vor der Reaktion hat Mg die Oxidationszahl +-0, nach der Reaktion +2. 0 ist kleiner als +2, also hat Magnesium Elektronen abgegeben, es fand hier eine Oxidation statt.
Also kannst du mir bitte noch sagen, wie ich jetzt die Lücke ausfüllen soll?
Wo hast du denn noch Unklarheiten?
Bzw verstehe ich gerade nicht, welche Lücke du meinst :7
Nichts🤦🏻♀️ Sorry... ich habs verstanden was ich machen sollte
Oh jaaaa Vielen Dank =) 🙏🏼🙏🏼 das hilft mir sogar sehr ...