Wie bei einem Säure/Base- Gemisch pH-berechnen?
Hallo zusammen..
Ich komme bei einer Aufgabe nicht weiter. Die Fragestellung lautet:
"Maleinsäure ist eine schwache zweiprotonige Säure mit pKa1 = 1.92 und pKa2 = 6.27. Eine Lösung von Maleinsäure in Wasser mit einer Konzentration von 20 mM wird hergestellt. 100.0 mL der Maleinsäure-Lösung werden mit 1.0 mL einer 3.5 M NaOH Lösung gemischt.
ii) Welchen pH-Wert hat das neue Gemisch (gerundet auf eine Dezimalstelle)?
Wie würdet ihr das berechnen?
Ich habe mir überlegt: Ich habe (0.02M*0.1l) > also 0.002 mol Maleinsäure (H2B)
und (3.5M*0.001l) > 0.0035 mol OH- Anionen.
Somit könnte in einem ersten Schritt 0.002 mol der Maleinsäure mit 0.002 mol OH- neutralisiert werden. Bleibt also übrig noch 0.0015 mol OH- Anionen und 0.002 mol HB- Säure. Die 0.0015 mol OH- könnten demnach noch 0.0015 mol HB- deprotonieren. Es würden dann letztlich noch 0.0005 mol der HB- Säure bleiben.
Dann hätte ich die Formel für schwache Säuren angewandt um die H3O+ Konezntration im Wasser noch zu bestimmen. Leider scheine ich einen viel zu niedrigen pH zu erhalten...
Danke für eure Inputs!
1 Antwort
Wir haben eine 0.02 mol/l Lösung von Maleinsäure (die hat übrigens einen pH=1.97). Davon nehmen wir 100 ml (entspricht n=cV=2 mmol) und versetzen mit 1 ml einer 3.5 mol/l NaOH-Lösung (entspricht n=cV=3.5 mmol).
Jetzt denken wir pur stöchiometrisch und führen gedanklich die Neutralisation aus: Wir brauchen 2 mmol NaOH, um alle Maleinsäure zu Hydrogenmaleat umzusetzen. Dann bleiben noch 1.5 mmol NaOH übrig, die ergeben 1.5 mmol Maleat, und 0.5 mmol Hydrogenmaleat bleiben übrig:
H₂Mal + OH¯ ⟶ HMal¯ + H₂O
HMal¯ + OH¯ ⟶ Mal²¯ + H₂O
Unsere Lösung ist also exakt gleich, wie wenn wir 1.5 mmol Maleat und 0.5 mmol Hydogenmaleit in Wasser gelöst hätten. Eine slche Mischung ist aber ein Puffer, und zum Berechnen des pH können wir die Henderson–Hasselbalch–Gleichung verwenden. Die lautet bekanntlich
pH = pKₐ + lg (Maleat/Hydrogenmaleat) = 6.27 + log (1.5/0.5) = 6.75
Dabei musst Du den pK₂ einsetzen, weil der für das Gleichgewicht zwischen Maleat und Hydrogenmaleat zuständig ist; der pK₁ beschreibt dagegen das Gleichgewicht zwischen Maleinsäure und Hydrogenmaleat, aber nach Zugabe von so viel Base ist ja keine Maleinsäure mehr in der Lösung.
Und hier siehst Du als Bonus den pH bei tropfenweiser Zugabe der NaOH zu Deiner Lösung.
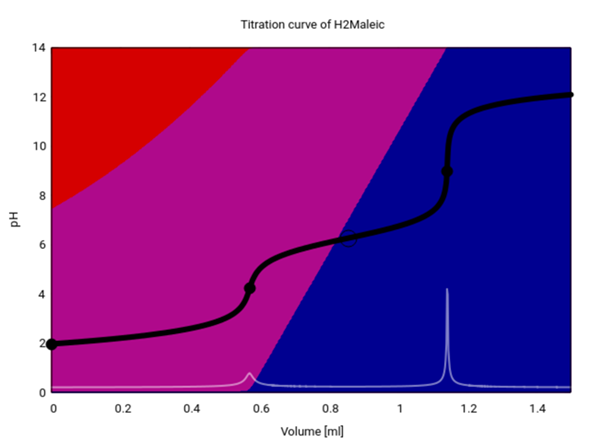
- Die schwarze Kurve zeigt den pH, die weiße die erste Ableitung davon.
- Äquivalenzpunkte sind mit schwarzem Kreis gekennzeichnet, der Pufferpunkt (gleich viel Hydrogenmaleat wie Maleat) bekommt einen Ring.
- Die Hintergrundfarben codieren die Speziesverteilung: rot Maleinsäure, violett Hydrogenmaleat und blau Maleat.
- Du siehst, daß Maleinsäure mittelstark ist; in der 0.02 mol/l Lösung sind bereits 53% davon zu Hydrogenmaleat deprotoniert, und sie verschwindet im Verlauf der Titration bis zum ersten Äquivalenzpunkt. Da die Lösung immer weniger als 50% Maleinsäure enthält gibt es auch keinen Pufferpunkt auf dem Weg zum ersten pH-Sprung.
- Zwischen den beiden Äquivalenzpunkten wird das Hydrogenmaleat deprotoniert und zum Maleat umgesetzt.
- Bei 1 ml Verbrauch (entspricht Deiner Frage) haben wir genau ¼ Hydrogenmaleat und ¾ Maleat, genauso, wie wir es oben berechnet haben, und der pH ist wirklich gleich 6.75
Danke sehr! Ja klar, hatte das das Maleat vollkommen ausser Acht gelassen. Danke auch für deine tolle Titrationskurve..LG