Welche basen sind schwächer als Natronlauge?
2 Antworten
Moin,
da gibt es einige, ionische, aber auch ungeladene Moleküle. Beispiele sind
- Wasser (H2O)
- Ammoniak (NH3)
- Hydrogensulfid (HS^–)
- Acetat (CH3–COO^–)
Reicht das? Wenn nicht, schau hier:
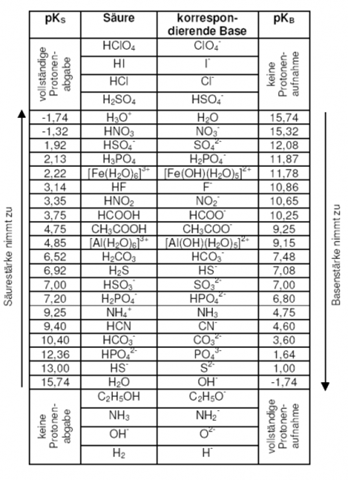
Da siehst du rechts an fünfter Stelle von unten das Hydroxidanion (OH^–) mit einem pKB-Wert von –1,74. Die Hydroxidanionen sind in Natronlauge die Teilchen, die das Ganze basisch (alkalisch) machen.
Nun ist jede Base darüber (angefangen beim Sulfidanion, S^2–) bis zum Wasser (H2O: +15,74) schwächer als das Hydroxidanion.
Die basischen Eigenschaften von den vier Teilchen ganz oben (Perchlorat, ClO4^–, Iodid, I^–, Chlorid, Cl^– und Hydrogensulfat, HSO4^–) sind sogar so schwach, dass hier in wässrigen Lösungen keine Protonenaufnahme stattfindet!
LG von der Waterkant
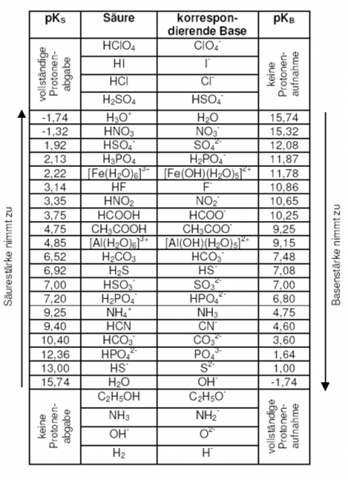
Guck dir einfach den pkb Wert verschiedener Basen an, kannst du googeln.
Je niedriger der wert desto stärker die Base.
Danke, aber ich bin bisschen blöd. Könntest du mir Beispiel lösungen nennen?