Was geschieht wenn man Cl2 in Wasser einleitet?
Und gleichnochmal muss das "Gutefrage-Team Schiedsrichter spielen.
Ich bin der Meinung, dass wenn man Cl2 in Wasser einleitet, die Reaktionsgleichung lauten müsste
Cl2 + H2O <-> Cl- + ClO- + 2H+
Jetzt gibt's aber auch Kommilitonen, die raus haben
Cl2 + H2O <-> ClO- + O- + 1/2 H2
Ich bin ein wenig verwirrt ob der alternativen Lösung. Also wieso man statt 2 H+ Atomen, 1/2 H2-Atome hat.
In der Vorlesung hatten wir einmal diese Notation Cl + OCl- + 2H+
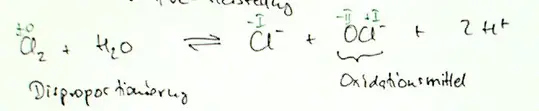
und diese: Clo + ClO- + 2H+
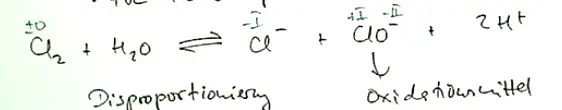
Ich hab jetzt also drei unterschiedliche Reaktionsgleichungen für die gleiche Reaktion vorliegen
- Cl2 + 2 HO <-> Cl- + OCl- + 2H+
- Cl2 + H2O <-> Cl- + ClO- + 2 H+
- Cl2 + H2O <-> ClO- + O- + 1/2 H2
Da mir mein Dozent wahrscheinlich mit dem nackten Gesäß ins Gesicht springen würde, wenn ich ihm in der Klausur drei unterschiedliche Lösungen hinschreibe ("Bei mehreren Lösungen gilt die Aufgabe als nicht gelöst"). dachte ich, ich frag mal nach, was die richtige Antwort sein könnte.
Mit gräulichen Füßen,
JensErdkunde8.Klasse,1.Halbjahr
3 Antworten
Man sieht schon an der Reaktionsgleichung
Cl2 + H2O <-> ClO- + O- + 1/2 H2
dass die nicht stimmen kann. Die Stöchiometrie stimmt ja gar nicht. Links stehen zwei mol elementares Chlor während rechts nur noch ein Mol übrig bleibt. Links ist ein Mol elementarer Sauerstoff während rechts auf einmal zwei Mol da sind.
Cl2 + 2 HO <-> Cl- + OCl- + 2H+
Ist vermutlich ein Tippfehler, es muss H2O heißen. Ob man nun OCl- oder ClO- schreibt bleibt sich gleich, man zeigt ja an, dass das gesamte Molekül negativ geladen ist. Ob die negative Ladung am Chlor oder am Sauerstoff steht, ist egal. Also OCl- und ClO- ist beides richtig.
okidoki, danke das hat mich die ganze Zeit verwirrt mit dem OCl- und ClO-.
Merci!
Wenn man sich die Reaktionsgleichungen einmal sorgfältig anschaut, dann müsste man das bei minimaler Kenntnis der Chemie unschwer selbst erkennen.
Cl2 + 2 H2O ⇌ Cl⁻ + OCl⁻+ 2 H⁺
Zähle einmal die H- und O-Atome auf beiden Seiten. dann wird schnell klar, dass es Murks ist.
Cl2 + H2O ⇌ Cl⁻ + OCl⁻+ 2 H⁺
Hier stimmt die Massenbilanz. Man kann alternativ auch formulieren:
Cl2 + H2O ⇌ HCl + HOCl
Cl2 + H2O <-> ClO⁻ + O⁻ + 1/2 H2
Das ist völliger Quark. Es disproportioniert lediglich das Chlor und nichts anderes. Keinesfalls wird Wasserstoff gebildet und ein O⁻ schon mal gar nicht. Außerdem stimmt die Ladungsbilanz nicht.
Natriumhypochlorit wird durch Einleiten von Chlorgas in Natronlauge
2 NaOH+Cl2⟶NaCl+NaOCl+H2O
Formal handelt es sich um eine Hydrolyse des Chlors.
H2O+Cl2⟶HCl+HClO
siehe Wiki
m.f.G.
anwesende