Warum ist der Unterschied beim Kalium größer als beim Calcium?
Beim Kalium ist die 2. Ionisierungsenergie etwa siebenmal größer als die 1. Ionisierungsenergie (Kalium: I1 = 419 kJ/mol, I2 = 3015 kJ/mol). Beim Calcium ist die 2. Ionisierungsenergie nur etwa doppelt so groß wie die erste (Calcium: I1 = 590 kJ/mol, I2 = 1145 kJ/mol).
Warum ist der Unterschied beim Kalium größer als beim Calcium?
2 Antworten

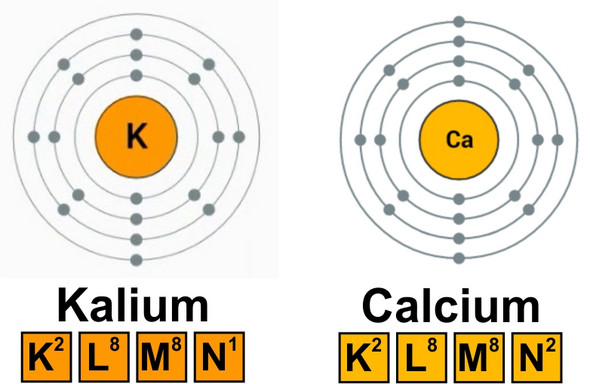
Aus zwei Antworten auf die gleiche Frage auf chemieonline.de schließe ich, dass das mit der Zahl der Valenzelektronen zu tun hat. Kalium hat ein Valenzelektron, Calcium zwei. Sobald man bei Kalium das Valenzelektron entfernt, hat es die Edelgaskonfiguration erreicht. Um ein weiteres Elektron zu entfernen, ist viel mehr Energie nötig.

Die Ionisierungsenergie ist die Energie, die benötigt wird, ein Elektron aus einen Molekül oder Atom herauszureissen. Kalium hat 1 Valenzelektron und Calcium 2. Dadurch wird es bei Kalium sehr schwer, ein Elektron aus der Nicht-Valenzschale zu entfernen. Das erste Elektron zu entfernen geht relativ einfach, da es eine volle Valenzschale haben will, jedoch wird es kaum noch ein Elektron abegeben. Das Calcium hingegen hat durch Abgabe von 2 Elektronen eine volle Schale und ist glücklich damit (Oktettregel). Es geht einfacher, das zweite Elektron zu entfernen.
http://www.chemieonline.de/forum/archive/index.php/t-183260.html
Sobald du Kalium ionisierst, hat es die Edelgaskonfiguration erreicht. Um ein K+-Ion zu ionisieren ist also eine viel größere Energie nötig, als die von Ca+, da Calcium 2 4s Elektronen hat.
http://www.chemieonline.de/forum/archive/index.php/t-129931.html

Schau dir mal die Ionisierungsenergie vom entsprechenden Edelgas an und dann hast du die Antwort.
P.S. Falls der Tip nicht reicht, zähle mal die Valenzelektronen der beiden Metalle und googel die 3.Ionisierungsenergie von Calcium.
m.f.G.
anwesende