Pufferbereich angeben und Ph-unterschied berechnen?
Verzweifel seit Stunden an dieser Aufgabe. Bin Chemie Lk Klasse 11, falls das weiterhilft.
vielen Dank im Voraus

1 Antwort
a) Der optimale Pufferbereich eines Systems aus schwacher Säure und dem korrespondierenden Säurerest ist prinzipiell derjenige pH-Wert, der dem pKs der Säure entspricht. Im vorliegenden Fall ist die Säure das Ammonium-Ion NH4⁺ und die die zugehörige Base der Ammoniak NH3. Der pKs von Ammonium ist 9,25. https://de.wikibooks.org/wiki/Tabellensammlung_Chemie/_pKs/pKb-Werte
b) Die Henderson-Hasselbalchgleichungbeschreibt die Zusammenhänge von Konzentrationen, pH- und pKs-Werten.
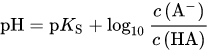
9 mL HCl mit c = 1 mol/L sind 0,009 mol HCl, die vollständig dissoziiert ist. Damit bringen wir also ebenso viel H⁺-Ionen in das Puffersystem. Der pH-Wert vor der Zugabe ist:
pH = 9,25 + log(0,1/0,1) = 9,25 + log(1) = 9,25 (Einheiten kürzen sich raus)
Durch die Zugabe von 0,009 mol HCl setzt sich ebenso viel Ammoniak in Ammonium um:
NH3 + H⁺ <--> NH4⁺
Damit sieht unser HH-Gleichung wie folgt aus_
pH = 9,25 + log[(0,1-0,009)/(0,1+0,009)] = 9,25 - 0,08 = 9,17
Der pH-Wert verschiebt sich als nur unwesentlich bei der Säurezugabe. Entsrechend kann man für die Basenzugabe rechnen.
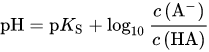
Perfekt! super erklärt:)
Für die Zugabe von NaOH wäre dann also ein Ph-Wert von 9,328 zu messen?
danke
müsste die Konzentration des Puffers nicht 1mol/l sein? Da es ja 0,1 mol pro 100ml sind.