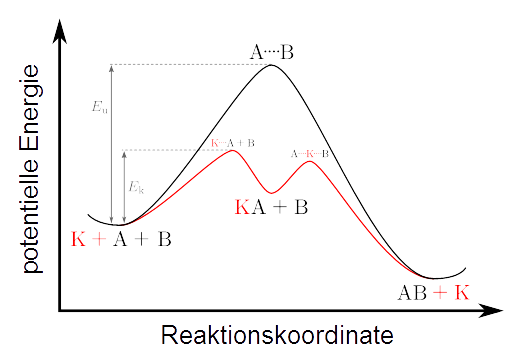
Katalysator Aktivierungs/Gesamtenergie
Hi Leute, ich wollte euch fragen ob meine Erklärung zu dem mitgelieferten Bild stimmt..
-Ein Katalysator senkt die Aktivierungsenergie einer Reaktion, aber nicht die Energiemenge die für die gesamte Reaktion notwendig ist, da es ja sozusagen zwei "Aufstiege" und zwei "Abstiege" gibt
Ist das richtig?
Danke im Vorraus :)
3 Antworten
Nein. Die Begründung ab dem "da" muss lauten: "... da die energetische Differenz zwischen Produkt und Edukt unabhängig von der Höhe der Aktivierungsenergie ist."
Nee, das ist falsch - der Berg nimmt wie du schon richtig geschrieben hast ab.. dh du brauchst weniger Energie hinzufügen damit deine Reaktion abläuft. Die zwei Hügel sind weder realistisch noch haben die Steigungen was damit zu tun Wichtig ist die Maximalhöhe des Berges und ob du diesen mit deinen Reaktionsbedingungen überqueren kannst. Wenn nicht, brauchst du einen Katalysator - sonst passiert gar nichts oder dein Ggw stellt sich nur extrem langsam ein.
Was gleich bleibt ist die Thermodynamik - dh das Energieniveau deiner Produkte und Edukte
Der erste Teilsatz ist richtig, der Rest gefällt mir nicht so gut. Fakt ist jedenfalls, dass die EnergieDIFFERENZ vorher / nachher die gleiche ist, mit und ohne Katalysator. Art und Anzahl dieser sogenannten Auf- und Abstiege sollten sich nach der Reaktionsordnung richten, denke ich mal. (Vermutung!).
Der erste Teilsatz war mir auch der wichtigste, danke :)^^
Stimmt es dass die Reaktion im Schaubild exotherm ist da die potentielle Energie am Ende geringer ist als am Anfang?