Isoelektrischer Punkt/pH=sauer/basisch?
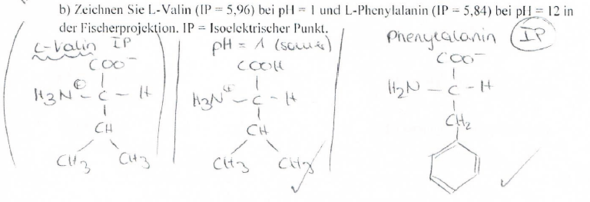
Angabe: Zeichnen Sie L-Valin (IP = 5,96) bei pH = 1 und L-Phenylalanin (IP = 5,84) bei pH = 12 in Fischer-Projektion.
Ich dachte, der IP sieht immer gleich aus, also mit der Konstellation: COO- und H3N+ Das Foto im Anhang beweist allerdings das Gegenteil - jetzt bin ich total verwirrt. Wie berechne ich, bzw. woher weiß ich, ob da COO-/COOH oder H2N/H3N+ stehen muss?
Ich dachte auch, dass die Konstellation bei saurem pH-Wert immer so aussieht: COO- und H2N und bei basischem so: COOH und H3N+
3 Antworten
Der isoelektrische Punkt entspricht einem pH-Wert bei dem die Aminosäure keine Ladung trägt, bzw. sich die positive und negative Ladung gegenseitig aufheben. Um welchem pH-Wert es sich dabei handelt ist abhängig von der Aminosäure (AS), also von ihrem Rest.
Ich stell mir das immer so vor:
Im Sauren liegen viele [H+] vor, sodass diese die basische Aminogruppe der AS protonieren (NH3 +). Steigt der pH-Wert ins basische, dann liegen entsprechend wenig [H+] vor, sodass die saure Carboxylgruppe der AS deprotoniert und es entsteht COO-.
Wann eine Aminosäure protoniert, bzw. deprotoniert wird, hängt von ihrer Basen- bzw. Säurestärke ab, die wiederum quantitativ durch den pKb-, bzw. pKa-Wert beschrieben wird. Man kann es also berechnen. In deiner Aufgabe geht es aber um einen stark sauren (pH=1) bzw. stark basischen (pH=12) pH-Wert. Bei diesen Werten liegt jede Aminosäure geladen vor.
LG
Ich dachte auch, dass die Konstellation bei saurem pH-Wert immer so aussieht: COO- und H2N und bei basischem so: COOH und H3N+
Nö, im sauren HOOC-CHR-NH3+ und im basischen -OOC-CHR-NH2
Jede AS hat seinen eigenen Isoelektrischen Punkt. Deswegen kannst du auch mit einem Gradienten-Gel mit aufsteigendem pH diese voneinander trennen. Das liegt an den Seitenketten.
siehe auch:
https://www.fh-muenster.de/fb1/downloads/personal/juestel/juestel/chemie/Aminosaeuren.pdf