Gefrierpunktserniedrigung?
Hey ich brauche Hilfe bei der Aufgabe
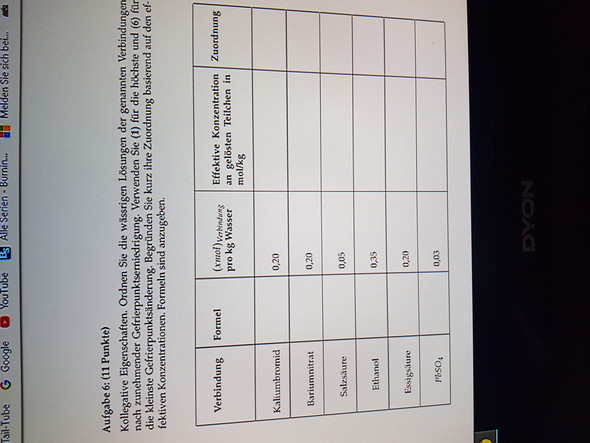
Also bei der ersten also KBr, dass da ja zwei Teilchen entstehen in wasser gelöst: K plus und Br Minus.
Also dann 2 mal 0,2 gleich 0,4. Das ist dann die effektive Konzentration an gelösten Teilchen an mol/kg
Nun die Frage bei den anderen. Bei den dreien ist es ja so, dass ja jeweils auch h plus entsteht, was aber ins wasser mit einbezogen werden kann und man so gesehen nicht wie ob das Prinzip machen kann. Wie macht man das???
Danke^^
1 Antwort
hmm, HCl dissoziert quasi vollständig und das würde ich auch so berücksichtigen...Essigssäure dissoziiert dagegen nur schwach, was auch von der Konzentrarion abhängt, weshalb man den pKs braucht! Bleisulfat ist quasi unlöslich, dafür bräuchte man das Löslichkeitsprodukt.
Du sollst ja auch etwas 'zuordnen' ... stehen da schon Werte, die man nur eintragen muss? Dann wäre es deutlich leichter zu schätzen!
Für ein Ranking würde ja eine grobe Schätzung reichen, für genauere Angaben muss man mindestens 2x genauer rechnen...pH-Wert schwacher Säuren und Löslichkeitsprodukt von unlöslichen Salzen!
Ba(NO3)2 besteht aus 3 Ionen, HCl zerfällt in 2, EtOH gar nicht, HOAc in 1-2 und BleiSulfat ist fast unlöslich. Mit den Konzentrationen kommt man meist leicht auf Konzentrationen, bei HOAc und PbSO4 auf einen Schätzbereich (0,2-0,4 mol/Kg und 0,0 mol/Kg)
Erstmal danke für deine antwort^^
Ne, also das was im Bild ist, ist die ganze Aufgabe. Sonst ist nichts im Anhang oder so gegeben. Also bei hcl kann man dann sagen, dass da nichts mit passiert, weil es sich vollständig dissoziiert?
Ich muss das vom höchsten bis zur niedrigsten Änderung einstufen, aber wie???😅😒
Bitte um schnelle Hilfe, weil morgen schon die Klausur ist 😅