Chemie-Valenzstrichformel-schwer?
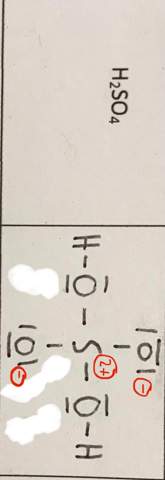
1) Ist das so richtig (rote), dass man durch ausgeglichene Ladungen von + und - hier nur entsprechend auf die Formel kommen kann (denn die Ladungen ergeben ja insgesamt null), obwohl eigentlich man ja Ladungen bei Ionen nur benutzen kann? Also kann man Ladungen auch zum neutralen Ausgleichen (von Molekülen) benutzen?
2) —> stimmt dann also auch meine Ladungsverteilung auf die einzelnen Atome, also kann ich auch einem Atom statt nur einer auch mehrere Ladungen (wie 2+ beim S) vergeben?
danke!!!
1 Antwort
Das ist so völlig richtig - die Ladungen, die Erklärungen, alles. ;)
(Nach veralteter Vorstellung gab es beim Schwefel eine Hypervalenz, sodass Schwefel auf 6 Bindungen kam. Aber deine Schreibweise ist die aktuell richtige. Nur damit du dich ggf. nicht wunderst, wenn du das Molekül irgendwo einmal anders gezeichnet findest.)
VG
MCX (Chemielehrer)
Wobei man die Variante mit 6 Bindungen auch immer noch findet und man diese mMn wg. der Vereinfachung nicht als 'falsch' bewerten sollte. Immerhin kann ja Schwefel auch 6 Bindungen ausbilden (SF6). Das größere Problem sind die Doppelbindungen, die man aber eben bei SO2 und SO3 ebenfalls zur Vereinfachung einzeichnet.