Chemie Salze erstellen?
Hey Leute, könnt ihr 5 Salze erstellen ein Kation von Hauptgruppe 1-3 und ein Anion von 7-8. Mir fällt nichts ein
1 Antwort
Hier siehst du das Periodensystem. Hier fehlen Nebengruppenelemente und Lanthanoide bzw. Actinoide, die sind für dich aber sowieso nicht relevant.
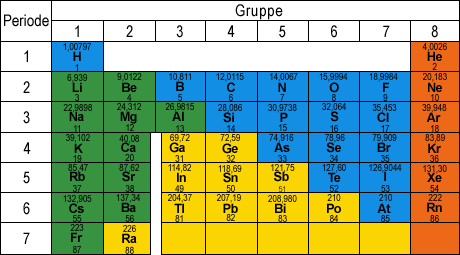
Salze bestehen aus Kationen und Anionen. Kationen sind positiv, Anionen negativ geladen.
Salze bestehen aus Metall und Nichtmetall. Metalle sind hier grün markiert, Nichtmetalle blau. Jetzt musst du nur gucken, dass du dir ein grünes und ein blaues aussuchst und guckst, dass du die beiden in dem Verhältnis zusammenpackst, dass die Gesamtladung 0 ist.
Beispiel Kochsalz, Natriumchlorid, NaCl
Natrium: 1. Hauptgruppe, 1-Fach positiv geladenes Natriumion
Chlor: 7. Hauptgruppe, 1-Fach negativ geladenes Chloridion
Beide sind 1-Fach geladen, somit ist das Verhältnis 1:1, das Salz wäre NaCl
Beispiel Calciumchlorid
Calcium: 2. Hauptgruppe, 2-fach positiv geladenes Calciumion
Chlor: 7. Hauptgruppe, 1-fach negativ geladenes Chloridion
Damit die Gesamtladung 0 ist benötigst du genausoviele negative wie positive Ladungen. Also 2 Chloridionen und 1 Calciumion, das Salz wäre CaCl₂
Beispiel Aluminiumoxid
Aluminium: 3. Hauptgruppe, 3-fach positiv geladenes Aluminiumion
Sauerstoff: 6. Hauptgruppe, 2-fach negativ geladenes Sauerstoffion
Damit die Gesamtladung 0 ist benötigst du genausoviele negative wie positive Ladungen. Also 2 Aluminiumionen und 3 Sauerstoffionen, das Salz wäre also Al₂O₃.
Und so kannst du super viele bilden.
Drei habe ich dir schon genannt, den Rest schaffst du auch selber, nur mal etwas nachdenken.
Generell kannst du die Elemente der 1. bis 3. Hauptgruppe mit denen der 7. Hauptgruppe passend kombinieren.
Außerdem kannst du vor Allem mit Sauerstoff auch viele Kombinationen schaffen. Insgesamt gibt es über weit 60 Möglichkeiten, da findest du schon noch 2, wenn nicht sogar mehr.
Eben nicht. Chlor ist maximal 1-Fach negativ geladen. Es nimmt ein Elektron auf und hat damit den Edelgaszustand erreicht. Elemente der 7. Hauptgruppe nehmen 1 Elektron auf und haben den Edelgaszustand erreicht, Elemente der 6. Hauptgruppe nehmen 2 Elektronen auf und haben den Edelgaszustand erreicht. Elemente der 1. Hauptgruppe geben 1 Elektron ab und haben den Edelgaszustand erreich, Elemente der 2. Hauptgruppe geben 2 Elektronen ab und haben den Edelgaszustand erreicht.
Calcium gibt also 2 Elektronen ab, Chlor nimmt 1 auf. Dann benötigst du 2 Chloridionen und ein Calciumion um eine elektrisch neutrale Verbindung zu erhalten.
Deswegen schreibt man CaCl₂, die tiefgestellte 2 sagt dir, dass du 2 Chloridionen hast.
Muss bei Calcium und Chlor, das Chlor nicht ebenso 2 fach negativ geladen sein?