Chemie Hausaufgaben Dipol?
Wir haben gerade das Thema DIpolmoleküle im Unterricht und ich verstehe die Hausaufgaben nicht...
Wir müssen diese Beobachtungen begründen:
a.) Reibt man einen Kunststoffstab mit einem Wolltuch und bringt ihn in die Nähe eines feinen Wasserstrahls, wird der Wasserstrahl vom negativ aufgeladenen Kunststoffstab angezogen (Abb.1).Wasser-Moleküle tragen offenbar positive und negative Ladungen, obwohl sie elektrisch neutral sind.
b.) Ein dünner Strahl des Lösemittels Tetrachlormethan (CCl4) wird durch einen geladenen Kunststoffstab nicht abgelenkt.
Danke für eure Hilfe!!!
2 Antworten
Hallo Corni763,
Begriff Dipol:
Ist die Anordnung zweier gleich großer elektrischer Ladungen (oder magnetischer Pole ; für uns nicht relevant) mit entgegengesetzen Polaritäten (Gegensätzlichkeiten; Also + und - ) in einem geringen Abstand.
Wenn du dir Wasser (H2O) betrachtest, dann hast du Sauerstoff und Wasserstoff in dieser chemischen Verbindung, die sich durch die Columbkräfte anziehen. Sauerstoffatom hat eine höhere Elektrongegativität als das Wasserstoffatom. Demnach haben wir eine Polare Bindung vorliegen. Sauerstoff besitzt in der Verbindung eine negative Partialladung und Wasserstoff eine positive Partialladung.
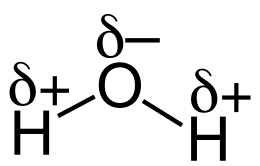
Wasser ist auch ein Dipol (jedoch ist der Ladungsschwerpunkt verteilt; fällt also nicht zusammen; es existiert daher ein Dipolmoment p). Dieses kann auch berechnet werden, ist aber hier zu umständlich.
Durch das Dipolmoment ist Wasser auch ein nach außen wirkender Dipol. Wenn du also einen positiv geladenen Stab hast und ihn an den Wasserstrahl hälst, dann ziehen sich der positiv geladene Stab mit der negativ geladenen Partialladung des Sauerstoffatom an. Beim CCl4 passiert das jedoch nicht, weil bei dieser Verbindung kein Dipolmoment existiert (weil der Ladungsschwerpunkt zusammenfällt; wegen der räumlichen Struktur), und daher ist CCl4 kein Dipol und es wirkt somit auch kein Dipol nach außen. Deshalb gibt es keine Ablenkung durch den Kunststoffstab.
Mit freundlichen Grüßen
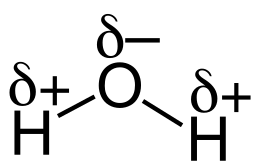
Wasser hat keine tatsächliche Ladung, da Sauerstoff im Gegensatz zu Wasserstoff sehr elektro negativ ist, zieht es die Elektronen zu sich, das nennt man dann Teilladung( O ist ein bisschen negativ, H ein bisschen positiv). Das alleine reicht aber nicht, ähnlich sieht es ja auch bei CCl4 aus(wenn auch nicht annähernd so stark). Der unterschied besteht in der Struktur des Moleküls. bei CCl4 sind die Teilladungen gleichmäßig nach innen und Außen verteilt. Das Wasser Molekül wird durch die Freien Elektronenpaare etwas gekrümmt wodurch die Teilladungen auf gegenüberliegenden seiten liegen