Chemie H+ Cl-?
Hallo ich schreibe am Freitag Chemie . Ich verstehe das immer noch nicht wie H+ und Cl- entsteht ( habe noch ein Bild beigehangen )
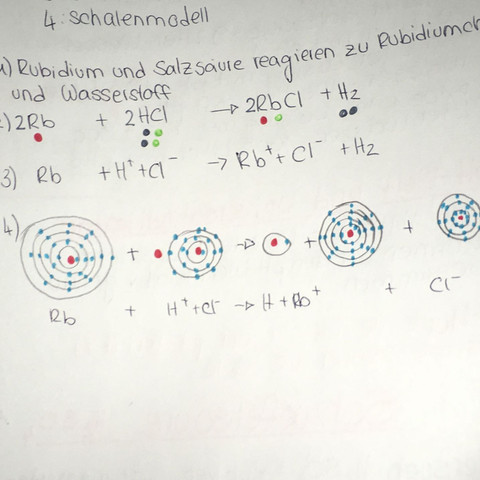
3 Antworten

HCl dissoziiert in wässriger Lösung zu H3O+ und Cl-. H+ existiert in wässriger Lösung NICHT.
HCl + H2O => H3O+ + Cl-
2 Rb + 2 H3O+ + 2 Cl- => H2 + 2 RbCl + 2 H2O
man kann das Wasser rauskürzen und erhält:
2 Rb + 2 HCl => 2RbCl + H2

H ist elektropositiv Cl ist stark elektronegativ das bedeutet es hat die Tendenz dem Elektropositiverem (in diesem fall H) ein Elektron zu entreißen.
Dadurch entstehen H+(dem jetzt ein Elektron fehlt bzw das jetzt nurmehr aus einem Atomrumpf besteht) und Cl- (das jetzt ein Elektron mehr hat als zu Anfang)

Wenn du bei HCl die Ladungen komplett trennen würdest, so hättest du die Teilchen H+ und Cl-. Nur ist HCl eigentlich nicht ionisch.