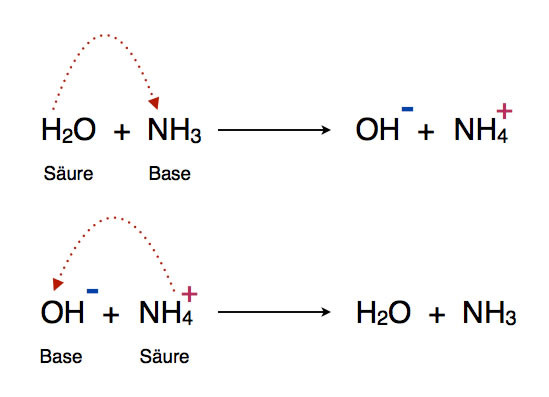
Welche Bedeutung hat die chemische Formel,,H2O+NH3- - - > OH- +NH4“ für die Säure-Base-Eigenschaften von Ammoniak?
1 Antwort
Diese Reaktionsgleichung sagt aus, dass beim Ammoniakwasser ein Teil der NH3 Moleküle zum NH4+ protoniert sind. Das ist eine Gleichgewichtsreaktion.
Das Ammoniakwasser hat einen basischen pH-Wert, weil das NH3 Protonen aus der wässerigen Lösung einsammelt.
Das Ammoniak Molekül ist immer ein Protonen-Akzeptor, somit ist Ammoniak immer basisch.
In dem gezeigten Text wird das verwechselt mit dem Ammonium, das ist sauer, es ist ein Protonen-Donator.
Beispiel: (NH4)2SO4 Ammonsulfat - reagiert sauer, es setzt Protonen frei, wenn es in Wasser aufgelöst wird.
Ich habe noch eine Frage zu diesem Thema und zwar spielt die Struktur von Ammoniak (tetraedisch) eine Rolle für die Säure-Base-Eigenschaften
@decordoba danke für deine Antwort ich bin denoch verwirrt auf zwei Seiten stand dass Ammoniak amphoter ist und zwar auf http://www.chemieunterricht.de/dc2/nh3/amphoter.htm und auf https://www.chemie.de/lexikon/Ammoniak.html
Was hat es dann damit zu tun ob es amphoter ist oder nicht ?
Das NH3 ist basisch - nicht amphoter - es fängt Protonen ein und wird damit zum NH4+ Diese Gleichung ist umkehrbar, wie in dem Beispiel oben zu sehen ist.
Wäre sehr nett würdest du es mir in den Nächsten Stunden erklären