reaktionsgleichung:Stickstoff reagiert mit Sauerstoff zu Distickstoffpentoxid ?
Ich muss für die Schule eine Reaktionsgleichung aufstellen! Leider weiß ich nicht wie ich das machen soll .
Ich habe keine Ahnung wie ich auf das Endergebnis kommen .
Wäre super nett wenn mir eine daß erklären könnte :)
Danke schon mal im Vorraus
Lg
2 Antworten
Am besten Schreibst du dir erstmal deine Ausgangsstoffe und das Reaktionsprodukt auf.
Stickstoff + Sauerstoff -> Distickstoffpentoxid
Danach ergänzt du aus dem Tafelwerk die chemischen Formeln darunter.
N2 + O2 -> N2O5
Die "2" und "5" bitte jeweils als Fußnote, da Stickstoff und Sauerstoff zu den Stoffen zählen, die in der Natur nur als Moleküle vorkommen.
Danach musst du "ausgleichen", damit links und rechts vom Reaktionspfeil die selbe Anzahl vom Atomen steht. Dabei darfst du nie die Grundstruktur deiner Formeln verändern, sondern nur ihre Anzahl. Vergleiche also nun die Anzahl der Atome links und rechts vom Pfeil. Du merkst dass es links nur 2 Sauerstoffatome, rechts 5 sind. Also suche ein gemeinsames Vielfaches (eine Zahl, die durch Zwei und Fünf teilbar ist), Zehn. Bringe also nun die Anzahl der Sauerstoffatome links und rechts auf 10. Wir wissen aber, dass du die Formel nicht verändern darfst. Also musst du herausfinden, welcher Faktor dich auf 10 bringt. 10:2=5 ; 10:5=2
Also:
N2 + 5 O2 -> 2 N2O5
Hier die vor den Formeln stehende Zahl nicht als Fußnote, sondern normal große Ziffer schreiben.
Jetzt befinden sich links 5 Sauerstoffmoleküle, bestehend aus 10 Sauerstoffatomen und rechts 2 Distickstoffpentoxide bestehend aus 4 Stickstoffatomen (die 2 vor der Formel für Distickstoffpentoxid gilt auch für die Stickstoffatome) und 10 Sauerstoffatomen. Nun prüfe erneut.
Du merkst, dass die Anzahl der Sauerstoffatome ausgeglichen ist, jedoch befinden sich links nur 2 Stickstoffatome und rechts 4 befinden. Es sticht nun ohne großes Nachdenken ins Auge, die Anzahl der Atome links muss verdoppelt werden.
Also:
2 N2 + 5 O2 -> 2 N2O5
Diese "2" bitte auch wieder normal groß schreiben.
Überprüfe wieder die beiden Seiten und stellst fest, links befinden sich 4 Stickstoffatome, rechts auch. Links befinden sich 10 Sauerstoffatome, rechts auch.
Ich hoffe, ich konnte helfen, es ist nicht so kompliziert, wie es in meinem Text scheint.
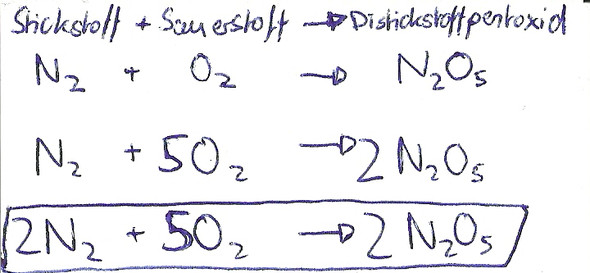
Die Gleichung ist richtig. Allerdings läuft die Reaktion niemals ab, weil sie positives ΔG hat; daher zerfällt N₂O₅ in die Element (kann explosiv sein), aber bildet sich nicht auf diesem Weg.
Dazu muss man aber Beachten, dass es verschiedene Verbindungen aus Sauerstoff und Stickstoff gibt.
(N2O, N2O4, N2O3, uvm.)
Es soll ja Distickstoffpentoxid rauskommen, wie der Fragesteller sagt.