Reaktion von Salpetersäure mit Schwefelsäure?
Zur Herstellung eines Nitroniumions kann man ja Salpetersäure mit Schwefelsäure reagieren lassen. In unseren Unterlagen wird die Reaktion wie in (1) aufgeführt (siehe Bild).
Mir würde die Reaktion wie in (2) formuliert jedoch logischer erscheinen: Das O, welches die negative Ladung trägt, "holt" sich doch viel eher ein Proton, als das O ohne positive Ladung...?
Hat die Formulierung (1) etwas damit zu tun, dass danach noch Wasser abgespalten werden soll und dies wie in (1) "besser" klappen würde? Aber so wie in (2) dargestellt würde sich ja doch auch noch das H2O abspalten...?
Oder mache ich einen Denkfehler und die Reaktion wie in (1) ist wahrscheinlicher?
Vielen dank schon mal für Hilfe! :)
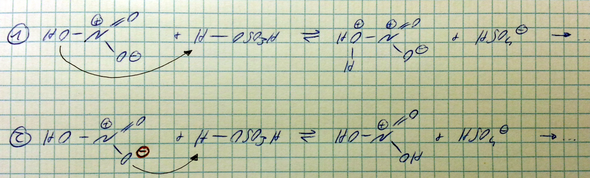
1 Antwort
1) Deine Darstellung der Salpetersäure ist eine mesomere Grenzstruktur, die das Molekül so fast nie einnehmen wird.
Eine realistischere Darstellung ist die im angehängten Bild. Die partiell negative Ladung befindet sich nicht an einem bestimmten Sauerstoffatom, sondern ist über das Molekül "verschmiert". Das Bild zeigt es nicht, aber auch das Hydroxyl-O ist am mesomeren System beteiligt.
2) Salpetersäure bildet mit ihrer Hydroxylgruppe in Wasser eine Wasserstoffbrücke zum Sauerstoffatom eines Wassermoleküls aus. Gleichzeitig bildet dieses Wassermolekül mit einem seiner Wasserstoffatome ein Wasserstoffbrücke zu einem den Sauerstoffatome der Salpetersäure aus.
http://pubs.acs.org/doi/abs/10.1021/jp980033p?journalCode=jpcafh
Durch solche Wasserstoffbrücken werden die Sauerstoffatome in der Salpetersäure gleichwertiger. Du hast ja nun mehrere Sauerstoffatome in der Säure die schon eine Bindung zu einem Wasserstoffatom besitzen. Daher gibt es dann vermutlich auch mehr als ein Sauerstoffatom, das Du protonieren kannst um Wasser vom Salpetersäuremolekül abzuspalten.
Also könnte man einfach ausgedrückt sagen, dass die negative (Formal-)Ladung im HNO3 ungefähr gleich auf die drei O's verteilt wird (durch den Aquakomplex) und somit das O mit der direkten Bindung zum H eine etwas höhere Elektronendichte aufweist als die anderen zwei (da es zusätzlich die Elektronen der O-H Bindung etwas mehr zu sich "zieht") und somit die Protonierung an diesem O am wahrscheinlichsten ist? Oder zumindest nicht unwahrscheinlich...
Ja, die negative Ladung ist über alle drei O-Atome verschmiert. Allerding weist das O-Atom mit der direkten Bindung zum H-Atom keine höhere Elektronendichte auf. Die anderen beiden O-Atome haben eine etwas höhere Elektronendichte. Ein kleines Stückchen Wahrheit drücken die mesomeren Grenzstrukturen schon aus.
Allerdings gibt es nicht ein bestimmtes O-Atom, das immer die direkte Bindung zum H-Atom besitzt.
Geh doch mal auf folgenden Link und klicke da auf "Microsolvation" (ich weiß leider nicht wie ich Dir das Bild sonst zeigen soll :( )
http://www.chem.umn.edu/groups/kleopold/research.html
Dort siehst Du drei unterschiedliche Bilder, in denen ein Salpetersäuremolekül mit einer unterschiedlichen Anzahl von Wassermolekülen Wasserstoffbrücken bildet.
Schau mal das ganz linke Bild an ( das mit nur einem Wassermolekül). Du siehst, daß das H-Atom der Salpetersäure eine Wasserstoffbrücke zum O-Atom des Wassers ausbildet. Außerdem bildet ein H-Atom des Wassers eine Wasserstoffbrücke zu einem O-Atom der Salpetersäure.
In dieser Struktur können die Protonen in den Wasserstoffbrückenbindungen ganz leicht wechseln. Das Proton des Wassers kann zum O-Atom der Salpetersäure überwechseln und dort kovalent binden. Gleichzeitig kann das Proton der Salpetersäure zum O-Atom des Wassers wechseln und dort kovalent gebunden werden.
Das kann immer so hin und her gehen -Protonen-Pin-Pong eben. So wird mal das eine und mal das andere O-Atom der Salpetersäure das sein, das eine kovalente Bindung zu einem H-Atom besitzt. Es gibt nicht das eine O-Atom, das immer das eine H-Atom gebunden hat. Die Rollen wechseln ständig.
Was ist mit dem dritten O-Atom? Das hat bestimmt auch eine Wasserstoffbrücke zum Wasser ausgebildet. Im Bild wird das bloß nicht gezeigt.
Wie Du sehen kannst sind alle drei O-Atome einander ziemlich ähnlich. Die stehen alle im Kontakt mit einem Wasserstoffatom. Ok, eines der drei hat das Wasserstoffatom kovalent gebunden aber ein so riesiger energetischer Unterschied ist das jetzt auch nicht mehr. Eine Wasserstoffbrückenbindung ist schon halb kovalent.
Du kannst also jedes O-Atom mit dem Proton der Schwefelsäure protonieren, das Du willst. Auch wenn das O-Atom bei der Protonierung kein H-Atom ganz kovalent gebunden hat, kann sich das ganz schnell ändern wenn der Protonen-Ping-Pong einsetzt.
Irgendwie konnte ich das Bild nicht hochladen :(
Hier ist der Link zum Bild
https://simple.wikipedia.org/wiki/Nitric_acid#/media/File:Nitric_acid_resonance_median.png