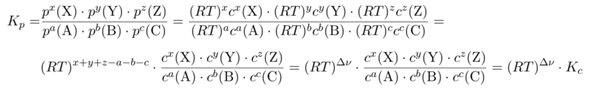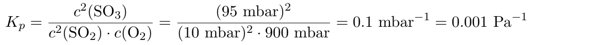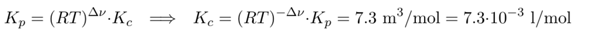Gleichgewichtskonstanten Kc und Kp berechnen?
Hallo, kann jemand bei folgenden Aufgaben helfen? Danke!

1 Antwort
Nach der Gasgleichung ist pV=nRT. Gleichzeitig ist die Konzentration ja c=n/V, also kann man die Gasgleichung zu p=cRT umschreibt; Druck und Konzentration sind also über den Faktor RT ineinander umzurechnen. Nun nehmen wir irgendeine Reaktion:
a A + b B + c C ⟶ x X + y Y + z Z
wobei die Großbuchstaben für Substanzen und die Kleinbuchstaben für die Koeffizienten stehen. Nun schreiben wir das Massenwirkungsgesetz für Kₚ (also mit Druck) auf und setzen ein, was wir aus der Gasgleichung gelernt haben, um zur Konzentration zu kommen:
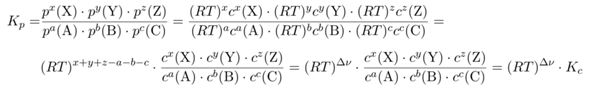
Dabei steht Δν für die Differenz x+y+z−a−b−b, also die Änderung der Teilchenzahl durch die Reaktion. Bei Reaktionen mit Δν=0 (z.B., H₂+Cl₂⟶2HCl) sind daher die beiden Gleichgewichtskonstanten gleich (und auch dimensionslos).
Das Gelernte kannst Du mit der nächsten Aufgabe sofort in die Praxis umsetzen. Das Kₚ können wir aus den gegebenen Gleichgewichtsdrücken direkt ausrechnen. Um späteres Über-die-eigenen-Füße-Stolpern zu vermeiden, rechnen wir die Gleichgewichtskonstante in die SI-Einheit Pa um, und wissen, daß die Konzentration dann in der SI-Einheit mol/m³ herauskommen muß:
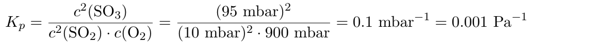
Und dann können wir den Schlunz blind auf Konzentrationen umrechnen, wie oben abgeleitet. Bei der Reaktion sinkt die Teilchenzahl von 3 auf 2, also Δν=−1, und die Temperatur ist 600 °C, also T=873 K:
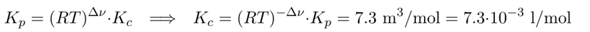
(Rechne das alles bitte selber nach, denn ich habe hier nur schnell eingetippt, ohne das Hirn aus dem Energiesparmodus zu holen).