Falsche Lösung Chemisches rechnen?
"Berechne die Stoffmenge (mol) , folgender Stoffportionen: 35g Kaliumchlorid KCl . " es ist ja so dass brom, iod, chlorid, Wasserstoff und Sauerstoff etc. nicht alleine stehen dürfen. Also habe ich die Reaktionsgleichung wie unten auf dem Foto ausgeglichen. Aber im Internet steht dass es 0,47 mol sein müssen und nicht 0,93 Mol. Kann mir jemand erklären wieso ? :(
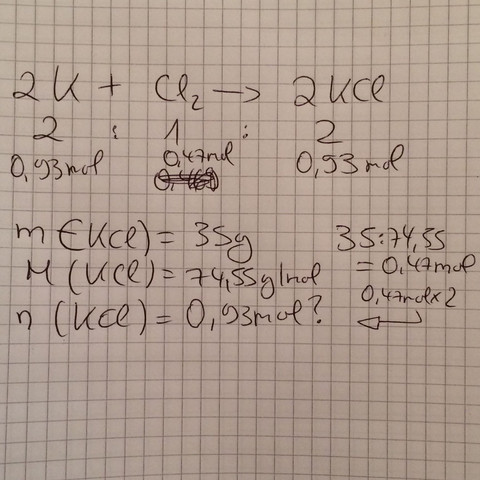
2 Antworten
Die Stoffmenge n in [n] = mol ist gesucht, die Masse m in [m] = g ist gegeben. Kaliumchlorid KCl ist die zu betrachtende Verbindung.
Um zu wissen wie viel mol an Kaliumchlorid vorhanden ist, muss ich in Erfahrung bringen wie viel Masse pro mol auf Kaliumchlorid kommt. Die Information liefert das PSE.
M(K) = 39,10 g/mol
M(Cl) = 35,45 g/mol
Gesetz von der Erhaltung der Masse:
M(KCl) = M(K) + M(Cl) = (39,10 + 35,45) g/mol
M(KCl) = 74,55 g/mol
Soweit hattest du alles richtig gemacht. Die Gleichung zur Berechnung der Stoffmenge n lautet:
n = m/M = 35,00 g / 74,55 g/mol
n = 0,4695 mol
Du hast die gleichen Schritte gemacht, dich dann an der Reaktionsgleichung orientiert und die Stoffmenge mit den Stöchiometriekoeffizienten von Kaliumchlorid multipliziert. Da du jedoch schon die Masse m in der Rechnung mit einbezogen hast, hattest du indirekt auch schon die Stoffmenge n mit inbegriffen.
Merke: Die Reaktionsgleichung liefert dir Informationen über die Stoffmengenverhältnisse zwischen verschiedenen Verbindungen (insofern ausgeglichen). Die Multiplikation hätte also den Zweck von einer Stoffmenge einer anderen Verbindung zu der Stoffmenge deines Kaliumchlorids zu kommen. Da du aber die Stoffmenge von Kaliumchlorid schon ausgerechnet hast, hast du quasi die Umrechnung von Kaliumchlorid zu Kaliumchlorid gemacht. Laut deiner Reaktionsgleichung kein gültiger Schritt, weil das einer anderen Reaktionsgleichung entsprechen würde.
Wenn du einfach nur eine Menge eines Stoffes hast, sind die Koeffizienten erstmal egal, die Reaktionsgleichung brauchst du gar nicht. Du musst nur die molare Masse von KCl ausrechnen (=M(K)+M(Cl)) und dann n=m/M.