Gib mal in deinem Computer bei der Suche ein "User Music" da findestdu das GTA radio und die songs wenn du den pfad ein paar schritte zurückgehst findest du den allgemeinen GTA ordner
Sie können seinen Spielernamen in Steam "Freunde" - "Freunde hinzufügen" eingeben und ihm eine Anfrage senden.
Oder Sie können Ihren Freundescode an ihn oder an ihn senden.
Bei der reversiblen Enzymhemmung bindet der Inhibitor I reversibel an das Enzym E und senkt somit dessen Aktivität bzw. die Geschwindigkeit der Reaktion des Substrates S zum Produkt P. Der Inhibitor kann aber zum Beispiel vom Substrat wieder verdrängt werden. Mathematisch gesehen gibt die Geschwindigkeitskonstante k2 die "Schnelligkeit" der ungehemmten Reaktion an. Bindet nun der Inhibitor an den Enzym-Substrat-Komplex ES so wird die Reaktion durch die Geschwindigkeitskonstante k6 definiert. k6 ist kleiner als k2. Da es sich um reversible Enzymhemmung handelt, stellt sich bei den Reaktionen zu ES, dem Enzym-Inhibitor-Komplex EI und dem Enzym-Substrat-Inhibitor-Komplex ESI ein Gleichgewicht ein. Alle Geschwindigkeitskonstanten auch für die Gleichgewichte sind in Abb. 1 an den entsprechenden Reaktionspfeilen abgebildet.
Im Fließgleichgewicht kann die Reaktionsgeschwindigkeit sogar rechnerisch bestimmt werden:
Durch Umformulieren erhält man folgende für die reversible Enzymhemmung allgemein gültige Gleichung für die Reaktionsgeschwindigkeit:
Die eingeführte Konstante V1 entspricht k2[E0] und die Konstante V2 = k6[E0]. Die Gleichgewichtskonstanten Kic und Kiu lassen sich aus Abb. 1 ableiten: Kic = k − 3 / k3 und Kiu = k − 4 / k4.
In Abb. 2 sind die wichtigsten Hemm-Mechanismen der reversiblen Enzymhemmung aufgeführt. Die Einteilung erfolgte in vollständige und partielle Hemmung, die sich in V2 unterscheiden. Bei der vollständigen Enzymhemmung liegt V2 bei 0, bei der partiellen ist dieser Wert ungleich 0. Das heißt das Enzym behält bei einer partiellen Hemmung seine katalytische Aktivität bei, die allerdings durch den Hemmstoff beeinflusst wird. Bei der vollständigen Enzymhemmung hingegen kann der ESI-Komplex nicht mehr an der Reaktion teilnehmen und ist somit inaktiv.
Die Produkthemmung ist ein Sonderfall der kompetitiven Hemmung, denn der Inhibitor entspricht dem Produkt der Reaktion. Auch die Substratüberschusshemmung ist ein Sonderfall der unkompetitiven Hemmung. Das Substrat ist in diesem Fall der Hemmstoff, wenn dieses in hoher Konzentration vorliegt.
Kompetitive Hemmung
Kompetitive Inhibitoren sind Substanzen, die mit dem Substrat um die Bindungstelle im aktiven Zentrum des Enzyms konkurrieren. Sie werden nicht umgesetzt und können dadurch vom Substrat wieder verdrängt werden. Kompetitive Inhibitoren haben oft hohe Ähnlichkeit mit dem Substrat. Der Mechanismus der kompetitiven Hemmung ist in Abb. 3 dargestellt. Deutlich zu sehen ist, dass das Enzym E das Substrat S und den Inhibitor I nicht gleichzeitig binden kann. Durch die reversible Bindung von S bzw. I an E entsteht ein Gleichgewicht zwischen freiem Enzym E, dem Enzym-Substrat-Komplex ES und dem Enzym-Inhibitor-Komplex EI. Unter der Voraussetzung, dass sowohl das Substrat S als auch der Inhibitor I in sehr viel höheren Konzentrationen als das Enzym E vorliegen, kann man für den steady-state-Zustand folgende Reaktionsgeschwindigkeitsgleichung formulieren:
Die enthaltenen Konstanten sind so definiert:
,
und
.
Die Reaktionsgeschwindigkeit ist in Abhängigkeit von der Ausgangssubstratkonzentration (S0) in Ab- und Anwesenheit des kompetitiven Inhibitors in Abb. 4 dargestellt. Die Michaelis-Menten-Konstante wird in Gegenwart des Inhibitors um den Faktor i erhöht. Die Maximalgeschwindigkeit Vmax bleibt jedoch unverändert.
Die Linearisierung der Michaelis-Menten-Auftragung wird durch den Reziprokwert der Gleichung erreicht.
Die doppelt reziproke Auftragung, also die Auftragung von 1 / v gegen 1 / [S0] in Gegenwart unterschiedlicher Konzentrationen des Hemmstoffes ist in Abb. 5 dargestellt und wird Lineweaver-Burk-Auftragung genannt. Die Steigung des Graphen erhöht sich in Anwesenheit des Inhibitors um i. Da Vmax unverändert bleibt, schneiden sich alle Geraden auf der Ordinate im Punkt 1 / Vmax. Die Schnittpunkte mit der Abszisse spiegeln den Wert − 1 / Kmi wider.
Die oben beschriebenen Gleichungen wurden für die kompetitive Hemmung abgeleitet, bei der die gleichzeitige Bindung von Substrat und Hemmstoff ausgeschlossen wird. Die Bedingungen für eine kompetitive Hemmung können aber auch erfüllt werden, wenn der Inhibitor nicht die gleiche Bindungsstelle am Enzym einnimmt wie das Substrat. Eine Bindung im aktiven Zentrum, wodurch die Substratbindung sterisch eingeschränkt ist, führt auch zum kompetitiven Hemmtyp.
Inhibierung durch ein konkurrierendes SubstratIn diesem speziellen Fall von reversibler Enzymhemmung ist das Enzym in der Lage zwei Reaktionen zu katalysieren, also zwei verschiedene Substrate zu binden. Das Enzym E bindet das Substrat A und setzt dieses zum Produkt P um. Die Bindung des Substrates B an das Enzym E führt zur Bildung von Produkt Q. Somit wird die Reaktionsgeschwindigkeit vA durch Zugabe des Substrates B verringert, da auch das zweite Substrat B gebunden und umgesetzt werden kann. Das eine Substrat wirkt bei dieser Konkurrenzreaktion auf die Reaktionsgeschwindigkeit der Reaktion des jeweils
anderen Substrates als kompetitiver Inhibitor. Dadurch ergeben sich folgende
Geschwindigkeitsgleichungen:
Nicht-kompetitive Hemmung
Bei der nicht-kompetitiven Hemmung wird durch die Bindung des Inhibitors I an das Enzym E die Substratbindung nicht beeinflusst. Der Inhibitor I ist somit in der Lage sowohl an das freie Enzym E als auch an den Enzym-Substrat-Komplex ES zu binden, d. h. der Inhibitor bindet nicht im Substrat bindenenden Teil des Enzyms, dem aktiven Zentrum. Das Substrat kann mit dem Enzym-Inhibitor-Komplex EI ebenfalls eine Reaktion eingehen, jedoch der gebildete Enzym-Inhibitor-Substrat-Komplex EIS ist nicht in der Lage das Produkt P abzuspalten. Der Reaktionsmechanismus ist genauer in Abb. 6 dargestellt.
Unter steady-state-Bedingungen kann eine einfache Geschwindigkeitsgleichung hergeleitet werden:
Die Konstanten Km und i sind folgender Maßen definiert: Km = k − 1 / k1 und i = 1 + (k3[I0] / k − 3). Aus der Geschwindigkeitsgleichung kann man ableiten, dass der nicht-kompetitive Inhibitor in Anwesenheit die Maximalgeschwindigkeit Vmax um den Faktor 1 / i verringert. Der Km-Wert für das Substrat bleibt unverändert.
Die Auftragung nach Lineweaver-Burk erfolgt unter Bildung der reziproken Reaktionsgeschwindigkeit nach dieser Formel:
Die Lineweaver-Burk-Auftragung ist in Abb. 8 dargestellt. Der Anstieg nach Zugabe des nicht-kompetitiven Inhibtiors ist i-fach höher als ohne Inhibition. Der Ordinatenschnittpunkt jeder Gerade liegt bei i / Vmax. Die Geraden für Reaktionen unterschiedlicher Inhibitorkonzentrationen schneiden sich in genau einem Punkt auf der Abszisse, im Wert − 1 / Km.
In manchen Fällen der nicht-kompetitiven Hemmung weicht das Verhalten des Inhibitors etwas vom "Normalfall" ab. Die Umsetzung des Inhibitors mit dem Enzym erfolgt dann sehr viel schneller als die des Substrates. Bei niedrigen Substratkonzentrationen ist die Verminderung der Maximalgeschwindigkeit nicht so stark. Daher ergibt sich für die Bedingungen k − 1 < < k2 und Km = k2 / k1 folgende Geschwindigkeitsgleichung:
.
Bei Ermittlungen des Hemmtypes eines Inhibitors sollte man mit einem solchen Verhalten rechnen.
Unkompetitive Hemmung
Gelegentlich kommt neben der kompetitiven und der nicht-kompetitiven Hemmung auch der unkompetitive Hemmtyp vor. Dabei geht der Inhibitor nur mit dem Enzym-Substrat-Komplex ES eine Reaktion ein, wie in Abb. 9 zu sehen ist. Die für diesem Mechanismus unter steady-state-Bedingungen abgeleitete Gleichung für die Reaktionsgeschwindigkeit lautet wie folgt:
Die Konstanten sind so definiert: i = 1 + (k3[I0] / k − 3 und Km = (k − 1 + k2) / k1. Aus der in Abb. 10 dargestellten Michaelis-Menten-Auftragung einer unkompetitiven Inhibierung kann man sehen, dass durch den Inhibitor sowohl die maximale Reaktionsgeschwindigkeit als auch der Km-Wert verändert wird.
Durch Umformung der Geschwindigkeitsgleichung in die reziproke Form kann die Abhängigkeit von Reaktionsgeschwindigkeit zu Ausgangskonzentration des Substrates linearisiert dargestellt werden:
Aus dieser Formel ist zu erkennen, dass der Anstieg unabhängig vom unkompetitiven Inhibitor ist, das heißt die Graphen liegen bei unterschiedlichen Inhibitorkonzentrationen parallel zueinander. Die Nullstelle gibt den Wert i / Km wieder. Die Geraden schneiden die Ordinate im Punkt i / Vmax.
Die unkompetitive Hemmung kommt zum Beispiel bei Oxidasen vor, wenn der Inhibitor nur mit einer bestimmten Oxidationsstufe des Enzyms reagieren kann. Eine weitere Möglichkeit für einen unkompetitiven Inhibitor bietet sich bei einem Ordered-Mechanismus, einer Zwei-Substratreaktion, bei der der Inhibitor konkurrierend zu einem der Substrate auftritt.
Partiell kompetitive Hemmung
Man spricht von einer partiell kompetitiven Hemmung, wenn durch Inhibitorbindung (I) lediglich die Affinität des Enzyms E zum Substrat S herabgesetzt wird, ohne dass die Geschwindigkeitskonstante zur Produktbildung (P) beeinflusst wird. Das bedeutet, dass auch nach Bindung des Inhibitors Produkt gebildet werden kann. In Abb. 11 ist der Mechanismus der partiell kompetitiven Hemmung dargestellt.
Für einen unter diesen Bedingungen:
- rapid equilibrium (Bindung des Substrats bzw. Inhibitors sehr viel schneller als Bildung des Produkts)
- hohe Inhibitorkonzentrationen
erfolgten partiell kompetitiven Hemmtyp kann die Reaktionsgeschwindigkeit so berechnet werden:
Aus dieser Geschwindigkeitsgleichung ist zu sehen, dass der Ks-Wert sich entgegen der kompetitiven Hemmung dem Wert K's annähert. Im Lineweaver-Burk-Diagramm ist die partiell kompetitive Hemmung nicht von der kompetitiven zu unterscheiden. Um diese aber dennoch zu differenzieren bedient man sich der Abhängigkeit des Ks-Wertes von der Inhibitorkonzentration, die in Abb. 12 dargestellt ist. Bei der kompetitiven Inhibierung stellt diese Abhängigkeit eine Gerade im Diagramm dar. Wie in der Abbildung zu erkennen ist, trifft dieser Sachverhalt nicht für die partiell kompetitive Hemmung zu.
Substratüberschusshemmung
Durch sehr hohe Substratkonzentrationen kann es bei manchen Enzymen zur Bindung eines zweiten Substratmoleküls an das Enzym kommen. Der so entstandene ESS-Komplex ist nicht in der Lage in Produkt und Enzym zu zerfallen. Für diesen Reaktionsmechanismus lautet die Geschwindigkeitsgleichung so:
Die Dissoziationskonstante des ESS-Komplexes wurde als Ki bezeichnet. Wenn der Km-Wert sehr viel niedriger als der Ki-Wert ist, erhält man eine hyperbole Abhängigkeit in der Michaelis-Menten-Auftragung (Abb. 13, Kurve 1). Sind diese beiden Werte annähernd gleich oder der Km-Wert höher, so entsteht sozusagen eine Optimumkurve (Abb. 13, Kurve 2).
Grundsätzlich muss Ihr PC die Systemanforderungen für GTA 5 erfüllen. Wenn GTA 5 ruckelt, haben Sie vermutlich die Grafikeinstellungen zu hoch angesetzt. Versuchen Sie Folgendes: Zunächst sollten Sie die Effektqualität ein wenig reduzieren
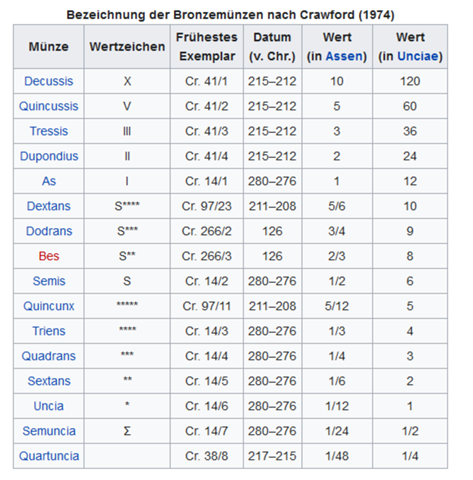
Dies ist eine Tabelle zum Münzwert römische Münzen.
https://prag.diplo.de/cz-de/aktuelles/-/2317418
Neben der Kommunikation sind Aufgaben auch eine hervorragende Möglichkeit, Ihre Glaubwürdigkeit in GTA 5 zu erhöhen. Wenn Sie die Aufgaben eines Monats im Spiel erledigen, können Sie 750.000 nur mit täglichen Aufgaben verdienen. Zeitfahren und Aufgaben helfen Ihnen auch dabei, das Guthaben auf Ihrem Konto schrittweise zu erhöhen.
Sie erhalten ein Abzeichen und zugehörige Erfahrungspunkte. Dies erhöht Ihr Steam-Profil, was Ihnen einige Belohnungen bringt.
Gehen Sie zum Online-Rücksendecenter und klicken Sie auf "Rücksendungen". Suchen Sie den Artikel, der in der Bestellung zurückgegeben werden soll, und klicken Sie bei der entsprechenden Bestellung auf "Zurück" oder "Artikel ersetzen".
https://www.digitaltrends.com/computing/best-graphics-settings-for-gta-v/
Katzen sind Menschen sehr nahe. Jens Lönneker vom Rheingold-Institut sagte, dass diese Tiere gleichzeitig niedliche Katzen und Tiger sind. „Wenn sie jemanden lieben, sind sie so unzugänglich wie die Zukunft, aber voller Frömmigkeit.“ Es ist diese Unvorhersehbarkeit, die viele Katzenbesitzer inspiriert hat, weil man nie weiß, welche Seite man treffen wird.
Im klassischen Sinne steht das Prinzip zwingend an oberster Stelle, im alltäglichen Sprachgebrauch wird dies aber weniger streng gehandhabt. Darüber hinaus gibt es einen Begriff von Prinzip, der eine Verkettung von Gesetzen
Du müsstst die Treiber auf neustem Stand halten
Die Antwort ist nur logisch, wenn es Beweise dafür gibt, dass sich jemand anders als jemand im Raum befand.
Andernfalls, Such an einem Ort, an dem kein Objekt vermutet wird.
Ihr WiFi muss bei 5 GHz sein. Sie müssen keine Einstellungen im Treiber vornehmen.
Du kannst auf deinem Email Konto, den Anbieter Wattpad individuell blockieren.
Ganz klar, der Veranstalter.
Wie man auf die Funktion kommt meinst du?