Wie kann ich die Oxidationszahlen folgender Stoffe ermitteln?
H20
C2H4
CCL4
SO2
SO3
N2O5
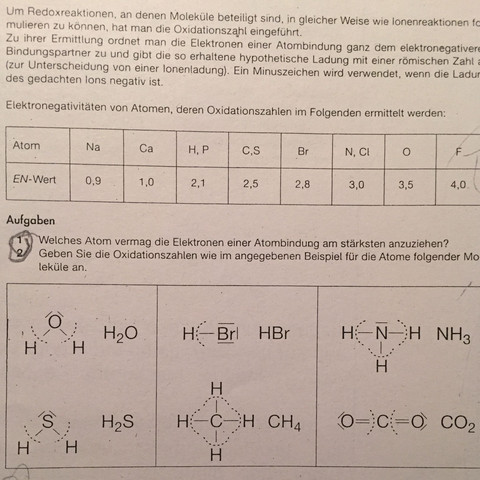
Kann mir jemand ausführlich erklären wie ich an die Oxidationszahl anhand der Summenfotmel und auch an Strukturfomeln ( im Bild) ermitteln kann?
Ich war leider nicht in der Lage für eine lange Zeit zur Schule zu gehen, nun muss Ich alles nachhholen, jedoch wird auf einem Gymnasium Selbständigkeit verlangt.
Darum bitte Ich um Hilfe.
Danke im Voraus!
2 Antworten

Hallo MottewillHilfe
Um die Oxidationszahlen (OZ) zu bestimmen gibt es eine Reihenfolge:
Ein einzelnes ungeladenes Atom hat die OZ 0 z.B.: C, Na
Ein Atom in einem Element hat die OZ 0 z.B.: Br2, Cl2, H2
Die Summe der OZ in einer ungeladenen Verbindung ist 0
Die Summe der OZ in einem Ion ist gleich deren Ladung z.B.: Cl^- OZ: -1
Ab jetzt kommt es auf die Elektronegativitäten (EN) an.
Fluor hat als elektronegativstes Element in Verbindungen immer die OZ -1
Sauerstoff hat in Verbindungen immer OZ -2 (Ausnahme sind die Peroxo-Verbindungen z.B.. H2O2)
Wasserstoff hat in Verbindung mit Nichtmetallen die OZ +1 z.B.: in H2O
Wasserstoff hat in Verbindung mit Metallen die OZ -1 z.B.: in LiH
In Nichtmetallverbindungen bekommt das elektronegativere Element die negative OZ
Wenn du diese Reihenfolge auf deine Verbindungen anwendest, solltest du das hinbekommen.
Bei dem ersten Teil der Aufgabe auf dem Blatt:
Du musst nur in die Tabelle darüber nachschauen, welches Element jeweils am elektronegativsten ist
Bei dem zweiten Teil der Aufgabe auf dem Blatt:
Hier kannst du nach der obigen Liste vorgehen. Außerdem ist schon eingezeichnet, zu welchem Element die Elektronen zugerechnet werden müssen.
Vielleicht das CO2 als Beispiel: O = 2x -2 daraus folgt C +4.
Man kann auch folgendes sagen: C hat 4 Außenelektronen im CO2 werden alle abgegeben, die Differenz ist dann +4
LG

Das würde ich gerne, aber ich kann das nicht darstellen. In deinem Aufgabenblatt ist es aber sehr gut dargestellt. Alle Elektronen, die innerhalb des 'Bogens' liegen zählen zu diesem Atom. Beim Methan zum Beispiel sind das alle vier Bindungen, bei HBr die eine Bindung, beim CO2 beide Doppelbindungen.
Also die Bindungselektronen immer zum elektronegativen Partner rechnen.
Dann kannst die Elektronen für ein Atom abzählen und nachschauen, wieviel Elektronen das Atom im 'Normalzustand' hat.
Beispiel: CO2
Die Bindungselektronen gehen alle zu den beiden O-Atomen.
O hat normal 6 Außen-Elektronen, jetzt hat es 8. Die Differenz ist -2, also Oxidationszahl OZ: -2.
Der Kohlenstoff hat normal 4 Außen-Elektronen, jetzt hat er 0 Elektronen. Die Differenz ist +4, also OZ: +4
War es hilfreich?
LG

Wie ist die Oxidationzahl von CS2? Weil ich kein stoff gegeben hab, von der man 100% die oxidationszahl kennt.
Und sind die restlichen Oxidationszahlen richtig?
Und was muss ich unten machen?
Wäre mega lieb, wenn du mir weiter helfen würdest :)

Bei CS2 sind die Elektronegativitäten von C und S unterschiedlich, je nach dem welche Tabelle man nutzt. Nach Pauling hat S die gering höhere EN, so dass die EN von S -2 und die von C +4 ist.
Dies lehnt sich an die Verbindung CO2 an.
Wenn du mit 'unten' die Verbindungen auf deinem Blatt meinst, dann hab ich das schon in meinen Antworten beantwortet. Schau mal genau nach.
Die OZ aller Verbindungen findest du in meinen Antworten.

ich meine das unten eines anderes blattes xD

Iiiiiiiiiiiiih, das Blatt liegt quer, aber egal
Obere Teil:
H2S S: -2 und H: 2 x -1
PCL5 P: +5 da Cl 5 x -1 ist
CS2 hatten wir schon behandelt
NaH Na : +1 !!! und H: -1 !!!
Unterer Teil folgt

iiiiiiiiiiiiih, mein Nacken. aber egal
Wenn ich das richtig gelesen hab, dann musst du die Atome angeben, die oxidiert und die reduziert werden.
Reaktion des H2O2 Oxidation von Sauerstoff von -1 !!! nach 0 und Reduktion des Sauerstoff von -1 !!! nach -2
MgCl2 / HCl Ox des Magnesiums von 0 nach +2 und Red des Chlors von 0 nach -1
Mg / Cl2 Ox des Magnesiums von 0 nach +2 und Red des Chlors von 0 nach -1
MgO / HCl ist keine Redoxreaktion
Die mit dem Eisen Ox des Eisen von +2 noch +3 und Red des Sauerstoffs von 0 nach -2.

Sei mir bitte nicht böse, aber ich will es verstehen - wie kommst du auf diese Ergebnisse?

Warum sollte ich denn böse sein?
Beim H2O2 hat Wasserstoff die OZ +1, also 2 x +1 = +2. Da die Verbindung ungeladen ist, muss der Rest -2 sein. Da zwei O-Atome da sind, also jedes -1.
Bei den Magnesium-Reaktionen wird Mg automatisch zu +2 (Mg steht in der 2. Gruppe). Mit HCl entsteht Wasserstoff. In HCl hat er die OZ +1 und im H2 die OZ 0. Hier hab ich versehentlich MgCl2 als Ausgangsstoff geschrieben, es muss natürlich Mg heißen. Die OZ stimmen aber.
Bei der Reaktion von Mg und Cl2, hat Mg im MgCl2 wieder die OZ +2, Chlor wird vom Element mit OZ 0 zum Chlorid mit OZ -1 reduziert.
Bei der Reaktion mit dem Eisen: Im Fe(OH)2 hat Fe die OZ +2, kannst du herleiten über 2 H mit je OZ +1 und 2 O mit je OZ -2, ergibt als Summe -2, daher muss Fe +2 sein, da die Summe ium Fe(OH)2 gleich 0 sein muss. Analog geht die Herleitung für das Fe(OH)3
Ich hoffe, ich hab keinen Fehler gemacht.

Vielleicht noch eine Hilfe beim C2H2, dem Ethin mit Dreifachbindung. C ist etwas elektronegativer wie H, also bekommt es die Elektronen der H-C-Bindung ganz.
Die Elektronen der Dreifachbindung teilen sich beide C-Atome gleichmäßig.
Daher OZ von H: +1 und OZ von C: -1

Wenn du richtig überlegt hast, musst du folgendes ermittelt haben:
H2O: H +1 O -2
CCl4: Cl: -1 C: +4
SO2: S +4 O: -2
SO3: S: +6 O: -2
N2O5: N: +5 O: -2
--------
HBr: H: +1 Br: -1
NH3: H: +1 N: -3
H2S: H: +1 S: -2
CH4: H: +1 C: -4

Ist das richtig, was bisher steht?
Und was soll man unten machen?
Lg

Könntest du noch erklären wie ich anhand der strukturformel die Oxidationszahlen ermittel...
Also mit dem Einkreisen der Elektronegativität...