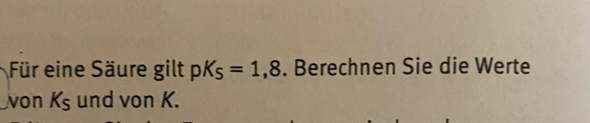Titration einer schwachen Säure: Warum entspricht im Halbäquivalenzpunkt der PH-Wert dem pKs-Wert?
Meine Überlegung:
Es gibt z. B. am Anfang 100 Mol von CH3COOH bei der Eduktseite Und nach der Gleichgewichtseinstellung gibt es 0,1 Mol CH3COO- (und H3O+) bei der Produktseite. (Was nicht stimmt, aber der Realität schon nah ist)
In diesem Zustand befindet die Probelösung, deren Konzentration zu ermitteln ist. (Angenommen, dass 100 Mol nicht bekannt ist)
Wenn man jetzt bei der Titration 1 Mol NaOH-Lösung zugibt (durch mehrere Tropfen), dann entsteht OH- -Ionen.
Dann reagieren zuerst 0,1 Mol OH- und 0,1 Mol H3O+ Ionen zu Wasser. Das bewirkt die Gleichgewichtsverschiebung, sodass mehr CH3COO- und H3O+ entstehen. Um die verbliebene Menge von OH- - Ionen, nämlich 0,9 Mol, weiter zu neutralisieren, reagieren im weiteren Verlauf auch zusätzliche 0,9 Mol CH3COOH-Moleküle mit Wasser (Weil es genug Wasser gibt, ist dessen Menge zu vernachlässigen) zu 0,9 Mol CH3COO- und H3O+.
Das heißt, wenn man 1 Mol NaOH zugibt, dann reagiert insgesamt 1 Mol CH3COOH zu CH3COO- und die verbliebene Menge von CH3COO- ist dann 1,1 Mol.
Weil bei der Produktseite tatsächlich viel weniger als 0,1 Mol CH3COO- gibt, kann man sagen, dass wenn man 1 Mol starke Säure in die Probelösung zugibt, genau so viel schwache Säure mit Wasser zum Säurerest (in diesem Fall CH3COO-) reagiert.
Schlussfolgerung: Wenn also die Hälfte der für die vollständige Dissoziation der schwachen Säure benötigte Menge von NaOH zugegeben wird (Halbäquivalenzpunkt), kann man gemäß der Begründung oben sagen, dass ca. genau die Hälfte der Ausgangskonzentration der schwachen Säure bei der Produktseite vorhanden sind. (Wenn die Ausgangskonzentration 1 Mol beträgt, dann ist es jeweils 0,5 Mol bei Edukt- und Produktseite)
Dann sind die Konzentration von H3O+ und von der schwachen Säure(die an der Eduktseite steht, in diesem Fall CH3COOH) gleich, sodass gilt:
Die HAC stammt von dieser Gleichung: HAC + H2O ⇌ AC- und H3O+)
Gibt es logische Fehler? Vielen Dank für Ihre Bemühung im Voraus.