Guten Nachmittag,
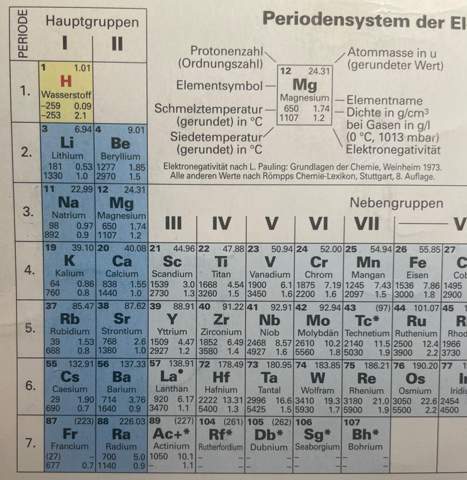
wie kann ich im Periodensystem der Elemente die Reaktivität der verschiedenen Elemente erkennen? Gibt es hier eine Struktur bzw. eine bestimmte Anordnung, anhand der man erkennen kann, ob die Reaktivität ansteigt oder weniger wird, wenn man mehrere Elemente miteinander vergleicht.
Als Beispiele habe ich hierzu zwei Aufgaben, vielleicht könnt ihr es mir ja anhand der Aufgaben erklären:
- Ordnen Sie die Alkalimetalle Kalium, Lithium, Rubidium nach steigender Reaktivität an.
- Welches Element ist das reaktivste Element im PSE? Geben Sid die hauptgruppe des PSE an, zu der es gehört.
Zur 1. Aufgabe weiß ich:
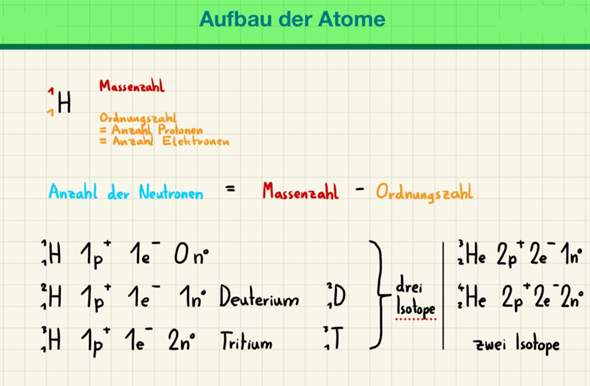
- Die Alkalimetalle kommen in der Natur nicht als reines Element vor
- Die Alkalimetalle müssen besonders aufbewahrt werden (Lithium, Natrium und Kalium in Paraffinöl und Rubidium und Cäsium in Ampullen, die verschmolzen werden)
- Alkalimetalle sind weich und leicht
- Alkalimetalle sind sehr reaktionsfreudig, da sie nur ein Valenzelektron besitzen. Aber wieso ist das so? Je mehr Valenzelektronen, desto weniger reaktionfreudig? Nein oder?
- Alkalimetalle kann man durch Flammenfärbung nachweisen, da jedes Alkalimetalle eine bestimmte Farbe bei der Verbrennung verursacht
Zur Aufgabe 2 weiß ich:
- Die 7. Hauptgruppe des PSE, also die Halogene, können mit fast allen Elementen reagieren und Bindungen eingehen, vor allem Fluor.
- Das chemische Verhalten von Fluor ist besonders aggressiv. Ich habe gefunden, das das an der Elektronegativität liegt, aber was das ist, weiß ich leider noch nicht.
- Ich würde daher als Antwort zur zweiten Aufgabe folgendes schreiben: Fluor ist das reaktivste Element aller Elemente im PSE. Fluor ist ein Halogen und gehört der 7. Hauptgruppe im PSE an.
Ich freue mich auf eure ausführlichen und leicht verständlichen Antworten.