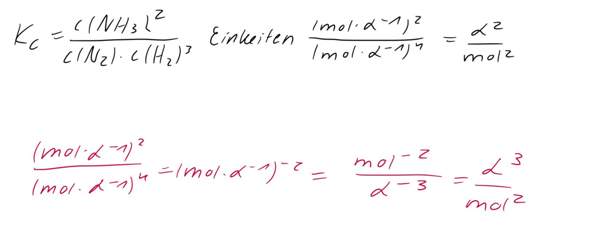Hey ihr😊
Ich habe folgende Aufgabenstellung
Zudem ist gegeben, dass eine gesättigte H2S Lösung 0,1 mol/l hat und ihr zusammengerechneter Ks Wert aus beiden Dissoziationsstufen 1,1×10^ -22 beträgt.
Die Lösung soll sein: c (Pb) = 2,3 × 10^ -7
Mein Ansatz wäre folgender:
Die Konzentration an H+ lässt sich aus dem ph Wert errechnen. Dafür erhalte ich 0,1995 mol/l.
Dann ermittel ich die noch bei der Fällung entstehenden H+ Ionen über das MWG von H2S:
H2S = 2H + S
1,1×10^ -22 = c^3
c (S2-) = 4,79×10^ -8 mol/l
c (H+) = 2,29×10^ -15 mol/l
Also müsste jetzt die Gesamtkonzentration an H+ 2,29×10^ -15 mol/l + 0,1995 mol/l betragen. Allerdings muss hier schon ein Fehler liegen, denke ich, da die H+ Konzentration aus dem H2S so klein ist, dass man sie ja vernachlässigen könnte. Demnach würde auch der Hinweis dazu in der Aufgabenstellung unnötig sein.
Ansich habe ich dann weiter gedacht, dass das PbS ja aus 1 S und 1 Pb entsteht. Wenn also 4,79×10^ -8 mol/l S verfügbar sind, reagiert das dann auch mit 4,79×10^ -8 mol/l von dem Pb. Somit wäre dann c (Pb), das nach der Fällung noch vorhanden wäre, 0,2 mol/l - 4,79×10^ -8 mol/l.
Aber so würden sich auch hier die Angangskonzentration von 0,2 mol/l kaum ändern weil meine errechneten Konzentrationen zu klein sind.
Hätte da jemand noch einen anderen Ansatz?
Vielen Dank im Vorraus 😊