Moin,
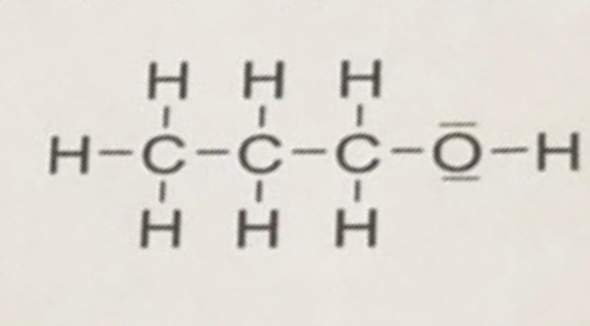
letztens im Chemieunterricht fingen wir mit Oxidationszahlen an und bekamen entsprechend Aufgaben, in welchen wir die Oxidationszahlen von Atomen innerhalb verschiedenster Bindungen bestimmen sollten. Eine dieser Bindungen war Ethylmethylether. Eine Person aus meiner Klasse meldete sich und behauptete die Oxidationszahl vom Sauerstoffatom des Ethers sei 0, da es hier als Element behandelt werden soll. Ich bin mir eigentlich 99% sicher, dass die Erklärung falsch sein muss, da das Sauerstoffatom in einer Bindung und nicht als Element vorlag (kann natürlich sein, dass ich hier einen Fehler habe).
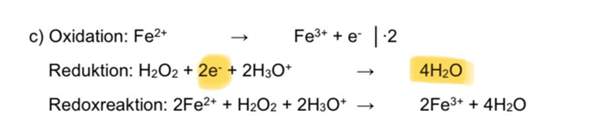
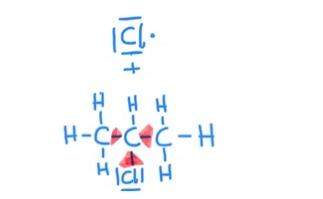
Also bin ich den Reaktionsmechanismus durchgegangen von dem man zu Ethylmethylether kommt, sprich eine Williamson-Ethersynthese bestehend aus Brommethan und Natriumethanolat durchgegangen. Da hier keine Oxidation oder Reduktion durchgeführt wird, sondern eine nucleophile-Substitution bei der hier keine Elektronen ausgetauscht bzw. abgegeben oder aufgenommen werden. Müssten die Oxidationszahlen eigentlich gleich bleiben.
Da das Sauerstoffatom in der Natriumethanolat-Bindung eine OZ von -2 hat, dürfte sich diese nicht verändern, selbiges müsste für die anderen OZ gelten, und somit müsste das Sauerstoffatom in der Ethylmethylether-Bindung eine OZ von -2 haben.
Ich hatte mich schon an meine Lehrerin gewendet aber sie schien sich nicht unglaublich sicher zu sein, meint aber dass meine Idee richtiger sei als die Idee, dass die OZ des Sauerstoffatoms 0 ist.
Auch frage ich mich, wie sich die Geschichte mit der OZ bei den Ethern verhält, also falls da jemand was weiß, wäre das hilfreich.
Ich würde mich über eine Antwort sehr freuen, auch wenn sie sehr lang und/oder komplex sein würd. Vielen Dank für eure Zeit.