Säurestärke von Phenolen?
Warum ist Aminophenol eine stärkere Säure als Nitrophenol?

(pKs=5,48)

(pKs=7,16)
1 Antwort

Da hast Du etwas mißverstanden.
- Der Grundkörper Phenol hat pKₐ=10, ist also nur schwach sauer.
- Die Nitrogruppe erhöht erwartungsgemäß die Säurestärke wegen des −M-Effekts, pKₐ=7.15.
- Die Aminogruppe senkt erwartungsgemäß die Säurestärke wegen des +M-Effekts, pKₐ=10.3.
Jetzt stellt sich die Frage, woher Du Deine Zahl pKₐ=5.48 für p-Aminophenol hast. Die kommt von der Aminogruppe, denn sie ist ja ein (lausige) Base und daher in protonierter Form H₃N⁺–C₆H₄–OH eine Säure. Dieser pKₐ-Wert ist etwas höher als der für Anilin (4.60), also ist protoniertes p-Aminophenol eine schwächere Säure als protoniertes Anilin, und umgekehrt Anilin daher die stärkere Base, beides wegen des −M-Effekts der Nitrogruppe.
In der folgenden Graphik siehst Du die Speziesverteilung beim p-Aminophenol. Rot ist das Kation (mit protonierte Aminogruppe, also das Ammoniumion), violett die Neutralform und blau das Anion (mit deprotonierte Hydroxygruppe, also das Phenolat). Die Graphik zeigt viel mehr als nötig, aber Du siehst, daß bei pH<5.5 die Aminogruppe protoniert und bei pH>10.3 die Phenolgruppe deprotoniert ist.
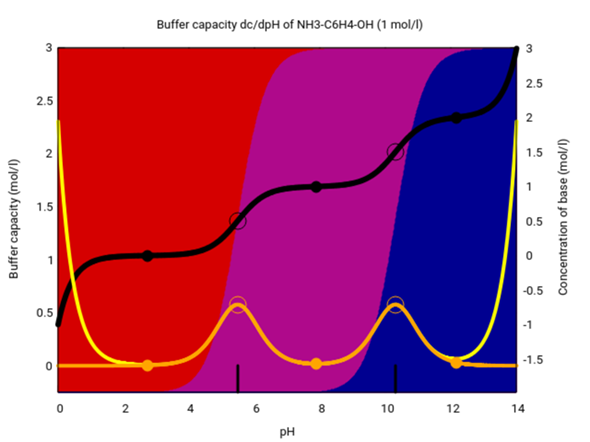
(Es reicht, wenn Du Dir die Hintergrundfarben ansiehst, die Kurven kannst Du ignorieren)
