Hey!
Im Laborpraktikum war heute die Aufgabe Cola(Aliquot von 60 mL) mit Natriumhydroxid (0,1 M) zu titrieren, um dann über den ersten Äquivalenzpunkt m/V [mg/L] anzusagen. Nun habe ich mich an einer Rechnung verbissen, und dann letztendlich über einen anderen Lösungsweg das Ergebnis richtig angesagt. Nun frag ich mich (meine Assistentin konnte mir dies auch nicht erklären), warum der erste Ansatz nicht hingehauen hat.
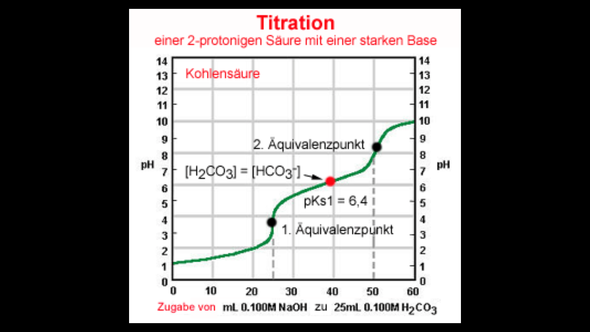
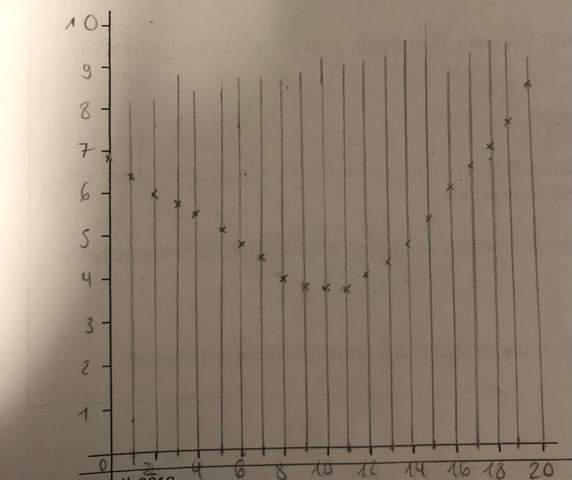
Nach Auftragung auf Millimeterpapier ergab sich der erste ÄP bei einem pH-Wert von 4,3 und einem verbrauchten Volumen an NaOH von 2,8 mL.
Der Ks - Wert liegt bei 7,5 *10^-3 (pKs = 2,12).
Das richtige Ergebnis ergab sich aus der verbrauchten Stoffmenge n(NaOH) = N(H3PO4) = V*c = 0,00028 mol
Daraus ergibt sich eine Konzentration von c (H3PO4) = n/V = 0,004666 mol/L.
Mit c=nV und n=m/M und M(H3PO4)= 97,994 g/mol ergibt sich m/V= cM = 457,319 mg/L.
So, alles schön und gut, so solls ja auch sein.
Jetzt zu meinem Problem: Ich hab mir über das Massenwirkungsgesetz die Formel für schwache Säuren hergeleitet: pH=1/2 (pKs - lg[H3PO4]) und darüber dann die Konzentration der Phosphorsäure am Äquivalenzpunkt berechnet:
[H3PO4]= 10^-(2*pH-pKs) mol/L=3,3113 * 10^-7 mol/L.
Nun wollte ich über c1V1=c2V2 auf die Ausgangskonzentration schließen:
c1= 3,3113 * 10^-7 mol/L * 0,0628 L (benutzt weil zu dem Aliquot noch 2,8 mL Flüssigkeit titriert wurden) * (0,06 L) ^-1 = 3,4658 * 10^-7 mol/L
Nun wieder die oben schon benutzte Formel m/V=c*M = 0,03396 mg...
Super^^ Wo liegt der Denkfehler? Warum funktioniert der zweite Ansatz nicht? Oder inwiefern müsste ich ihn modifizieren, dass er funktioniert?
Vielleicht kann da jemand durchsteigen ;)
LG Franzi