Kann mir jemand alles erklären (Chemie 8. Klasse)?

1 Antwort

Hi,
alles erklären wird vielleicht ein bisschen viel, aber ich probier's. Manches ist aber einfach Auswendiglernerei, deshalb beschränke ich mich auf die folgenden Hauptaspekte.
PSE und AtomeEin Atom ist die kleinste Einheit eines Elements. Es besteht aus Protonen, Elektronen und Neutronen.
Die Angaben im Periodensystem verraten uns sehr viel über das Atom:
- Ordnungszahl: Gibt die Anzahl der Protonen (und Elektronen) in einem Atom an. Deshalb wurde sie auch in die Kreise geschrieben.
- Massenzahl: Sagt uns, wie viel ein Atom (in u) wiegt. Die Massenzahl setzt sich zusammen aus der Masse an Protonen (je Proton 1 u Masse) und Neutronen (auch je 1 u). Das heißt, die Masse eines Atoms wird maßgeblich durch den Atomkern bestimmt, der aus Protonen und Neutronen besteht. Wenn du von der Masse also die Ordnungszahl abziehst, erhältst du die Anzahl der Neutronen.
- Hauptgruppe: Gibt an, wie viele Elektronen auf der äußersten Schale des Atoms sind (Valenzelektronen).
- Periode: Gibt die Anzahl der Schalen an.
Ich erkläre dir am Beispiel Natrium, wie man nach dem Bohrschen Atommodell ein Natriumatom zeichnet. Zunächst übernimmst du die Informationen, die du zu Natrium im Periodensystem findest, und interpretierst sie:

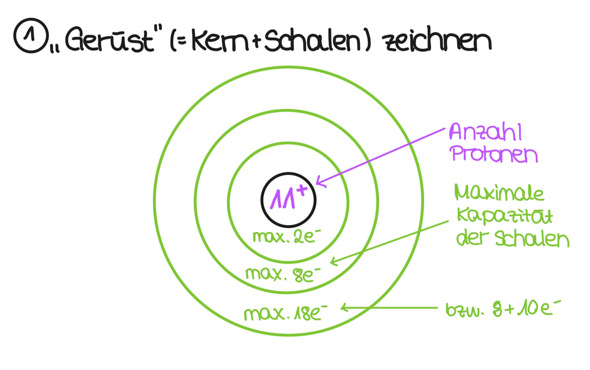
Wenn das geschehen ist, dann kümmerst du dich erstmal um das "Gerüst" des Atoms. Das heißt: Du zeichnest den Kern (der Kreis in der Mitte), trägst die Anzahl der Protonen ein und machst ein + oben rechts an die Zahl. as sagt aus, dass der Kern aus 11 Protonen besteht (und ein Proton hat ja eine Ladung von +1). Dann zeichnest du erstmal alle Schalen auf:

Du siehst, dass ich in die Schalen was von maximaler Elektronenzahl aufgeschrieben habe. Um das zu verstehen, schaust du am besten mal ins Periodensystem. Du siehst, dass in der ersten Periode nur H (also Wasserstoff) und He (also Helium) stehen. Das heißt: Nach zwei Elektronen ist diese Schale voll. Die nächste Schale kann schon acht Elektronen aufnehmen, da in der Reihe Lithium, Beryllium etc stehen, bis hin zum Neon. Auch bei der dritten Schal ist dies so. Warum aber habe ich da "18 bzw. 8 + 10" hingeschrieben? Das liegt daran, dass in der nächsten Periode die Nebengruppenelemente kommen und die die Schale davor auffüllen. Das heißt, die Nebengruppenelemente in Periode 4 füllen die dritte Schale auf. Für unseren Zweck reicht es aber, dass es erstmal die 8 Elektronen aus der dritten Periode maximal aufnehmen kann.
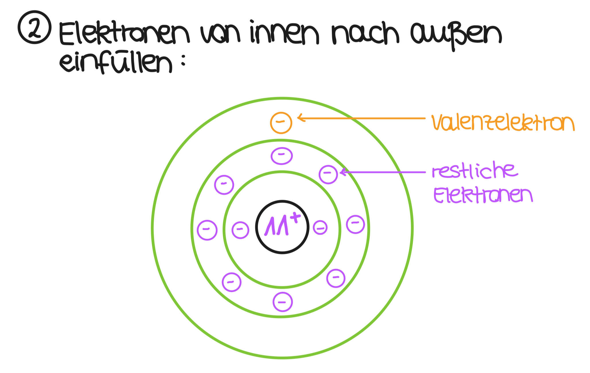
Nun hast du 11 Elektronen. Diese füllst du von innen nach außen auf:

Wenn du das so machst, hast du deine 11 Elektronen passend eingefüllt und, wie es die Hauptgruppe schon vorgibt, ein Elektron auf der äußersten Schale. Damit ist die Zeichnung des Natriumatoms schon fertig.
Lewis-SchreibweiseUm Atome in Lewis-Schreibweise darzustellen, gehst du wie folgt vor:
- Du suchst das Element im Periodensystem. Die Hauptgruppe gibt die Anzahl der Außenelektronen (= Valenzelektronen) vor.
- Du notierst das Elementsymbol.
- Du fängst an einer Seite an, einen Punkt zu setzen, und gehst im oder gegen den Uhrzeigersinn um das Element herum; ein Element hat maximal vier einzelne Elektronen (Punkte) um sich herum.
- Hat dein Atom mehr als vier Valenzelektronen, fängst du wieder von vorm an und zeichnest neben den ersten Punkt noch einen zweiten Punkt (bei 5 VE), neben den zweiten auch (bei 6 VE) u.s.w.
- Wenn du alle Valenzelektronen notiert hast, guckst du, wo überall zwei Punkte nebeneinander stehen. Dort machst du aus den zwei Punkten einen Strich.
Du hast also am Ende ein Elementsymbol mit Punkten (bis 4 VE), Punkten und Strichen (5 bis 7 VE) oder nur Strichen (bei 8 VE). Für das Beispiel Chlor heißt das:
- Chlor steht in der 7. Hauptgruppe, hat also 7 Valenzelektronen.
- Das Elementsymbol Cl notierst du.
- Dann zeichnest du die vier Punkte an den vier Seiten ein. Drei Elektronen bleiben übrig.
- Du fängst wieder von vorn an und zeichnest neben das erste Elektron direkt ein zweites. Das machst du noch zwei weitere Male. Dann hast du Cl mit einem einzelnen Punkt und drei Mal zwei Punkten nebeneinander.
- Die Elektronenpaare verbindest du zu einem Strich. Dann hast du ein Cl mit drei Strichen und einem Punkt.
- Nukleonen: So nennt man die Teilchen, aus denen der Atomkern besteht, also Protonen und Elektronen.
- Ordnungszahl / Kernladungszahl: Siehe oben unter "PSE und Atome".
- Isotop: Ein Isotop ist eine Atomart eines Elements, das eine bestimmte Anzahl an Protonen, Elektronen und Neutronen hat. Das heißt, das Kohlenstoffisotop ¹²C hat sechs Protonen, sechs Elektronen und sechs Neutronen. Die verschiedenen Isotope eines Elements unterscheiden sich durch die Anzahl der Neutronen. Die Anzahl der Protonen und Elektronen bleibt gleich. Das Kohlenstoffisotop ¹⁴C hat noch immer die Ordnungszahl 6, steht also an derselben Stelle im Periodensystem (isos = gleich, topos = Ort). Die Atommasse ist jetzt aber 14 u, also hat das Isotop 14 - 6 = 8 Neutronen. Die Isotope ¹²C und ¹⁴C unterscheiden sich also nur in der Anzahl an Neutronen.
- Edelgaskonfiguration: Edelgase haben acht (in der ersten Periode zwei) Elektronen auf der äußersten Schale. Wenn Stoffe miteinander eine Reaktion eingehen, so sind sie bestrebt, die Edelgaskonfiguration zu erreichen, also auch acht Elektronen durch Aufnahme oder Abgabe von Elektronen zu erreichen.
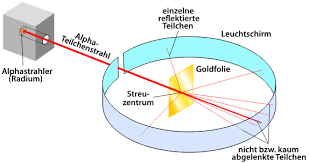
Der Streuversuch hat allgemein den Aufbau eines Atoms mit Atomkern und Elektronen (ohne nähere Details über deren Lokalisierung) gezeigt. Der Versuch hatte folgenden Aufbau:

Eine Goldfolie wird mit radioaktiven Teilchen (positiv geladen) beschossen. Rutherford sah, dass ein Großteil dieser Teilchen durch die Goldfolie hindurch flog, einige wenige Teilchen aber abgelenkt oder reflektiert wurden. Die wesentlichen Schlüsse, die man daraus ziehen kann, sind:
- Es muss positiv geladene Atomkerne geben. Diese sorgen nämlich für die Ablenkung einzelner Teilchen (Abstoßung zwischen Teilchen derselben Ladung).
- Die Elektronen sind sehr weit vom Kern weg und die Kerne sind sehr klein. Das erklärt, warum nur so wenige Teilchen abgelenkt wurden und der Großteil der Teilchen durch die Folie hindurch flog.
Den Rest kannst du googeln.
Wenn noch was unklar ist, frag gerne nach.
LG