Wieviel Lauge muss ich dazugeben, um zum Neutralpunkt zu gelangen?
Wenn ich eine schwache Säure mit einer starken Lauge titriere, wie kann ich dann berechnen, wie viel von der starken Lauge ich in die schwache Säure geben muss, um zum Neutralpunkt (pH=7) zu gelangen?
soweit ich gelernt habe ist beim Titrieren von schwachen Säuren der Neutralpunkt ungleich Äquivalenzpunkt
1 Antwort

Soweit ich Dich verstehe, willst Du folgende Frage beantwortet haben:
Ich habe eine Lösung einer potentiell mehrprotonigen Säure mit bekannten pKₐ-Werten und bekannter Konzentration. Wie kann ich ausrechnen, wieviel NaOH ich zugeben muß, um exakt pH=7 zu erreichen?
Das läßt sich tatsächlich ohne allzu große Schmerzen ausrechnen, und eigentlich ist das verwunderlich, denn Fragestellungen der Art „Welchen pH hat die Lösung“ sind viel schwieriger zu schlachten, und man muß entweder Näherungsformeln verwenden oder komplizierte Gleichungen numerisch erschlagen — exakte Gleichungen kenne ich nur für einbasige Säuren.
Der Kernpunkt zum Lösen des Problems ist, daß wir den pH-Wert kennen. Damit kennen wir aber auch die relativen Anteile der Säure, ihres Monoanions, ihres Dikations etc — sogar, wenn wir mehrere mehrbasige Säuren in der Suppe hätten, würde die Rechnung nicht wesentlich komplizierter werden, man müßte einfach eine nach der anderen durchrechnen.
Rechnen wir also den Fall einigermaßen allgemein mit einer n-basigen Säure durch, dann haben wir die Säurekonstanten K₁, K₂, K₃, … Kₙ mit ihren jeweiligen Gleichgewichten und den Konzentrationen c₀, c₁, c₂, c₃, … cₙ für die Spezies HₙX, Hₙ₋₁X¯, Hₙ₋₂X²¯, … Xⁿ¯. Wenn wir wüßten, welche Speziesverteilung am gewünschten pH vorliegt, dann wüßten wir sofort, wieviel NaOH wird zufügen müssen, nämlich genug, um die richtige Menge H⁺ von der Säure runterzureißen: c₁+2c₂+3c₃+…+ncₙ (natürlich noch zu multiplizieren mit dem Volumen, in dem das ganze stattfindet).
Was wir also wirklich brauchen, ist die Speziesverteilung am gewünschten pH. Und das geht einfacher als erwartet. Dazu schreibe ich die einzelnen Gleichgewichte mit ihren Gleichgewichtskonstanten an, und verwende das Symbol x für x=c(H₃O⁺)=10¯⁷ mol/l:
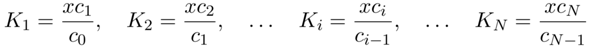
(ich kopiere die Formeln einfach aus einem Dokument heraus, das ich einmal geschrieben habe; dort steht N für die Zahl der Protonen in der Säure, aber hier im Text muß ich n schreiben, weil ich es sonst nur mit Schmerzen tiefstellen kann)
Diese Gleichgewichte kann man leicht als eine Art Rekursionsbeziehung formulieren, indem man sie einfach miteinander multipliziert:
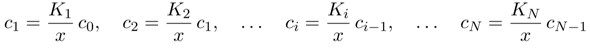
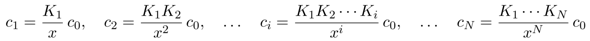
Diese Vorfaktoren, die im Zähler Produkte von Säurekonstanten sind und im Nenner eine Potenz von x haben, sind einfach die Verhältniszahlen für unsere Konzentrationen in der Endlösung. Man kann mit ihnen numerisch herumfummeln (oft sind einige so klein, daß man sie nicht zu berücksichtigen braucht), oder die Formeln zusammenfassen und auf die Gesamtmenge normieren, dann bekommt man den handlichen Ausdruck
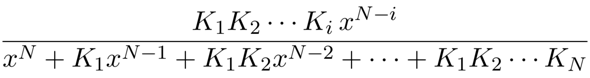
als Anteil der i-ten Spezies (also Hₙ₋ᵢXⁱ¯) in der Lösung bei pH=−lg(x).
Denken wir uns das an ein paar Beispielen durch. Der Anteil der maximal protonierten Form ist für unsere Anwendung nicht relevant (weil die ja kein NaOH verbraucht), und in der Praxis sind viele Anteile so klein, daß sie keine Rolle spielen.
- Als erstes Beispiel nehme ich die Zitronensäure mit den pKₐ-Werten 3.09, 4.75 und 5.41. Alle davon sind deutlich kleiner als 7, also können wir schätzen, daß bei pH=7 die Zitronensäure fast vollständig deprotoniert sein wird; man erreicht also pH=7, indem man die ca die dreifache Stoffmenge NaOH zugibt (also vollständig neutralisiert). Um es genau zu bekommen, berechnen wir die Anteile von H₃Cit bis Cit³¯ als 17 ppb (braucht man letztlich nicht), 0.014% (fast vernachlässigbar), 2.5% (nicht vernachlässigbar) und 97.5% (Hauptbrocken). Wir müssen also pro Mol Zitronensäure 0.000141 mol NaOH (zur Bildung von H₂Cit¯), zweimal 0.0251 = 0.0501 mol NaOH (zur Bildung von HCit²¯) und zuletzt noch dreimal 0.975 = 2.924 mol NaOH (zur Bildung des Cit³¯) zugeben, insgesamt also 2.9747 mol NaOH. Das ist knapp 1% weniger als die schnell geschätzten drei Mol.
- Dieselbe Rechnung mit H₃PO₄ (pKₐ=2.148, 7.198 und 12.319) gibt die Anteile 0.00086% für H₃PO₄, 61.2% für H₂PO₄¯, 38.8% für HPO₄²¯ und 0.00019% für PO₄³¯, und die nötige Stoffmenge NaOH beträgt dann 1.3879 mol NaOH pro Mol H₃PO₄.
So wie beschrieben, funktioniert das Verfahren nur für pH=7. Es läßt sich aber leicht zu beliebigen pH-Werten verallgemeinern, indem man das Wassergleichgewicht mitberücksichtigt, das gibt dann noch einen zusätzlichen Basenbedarf c(OH¯)−c(H₃O⁺). Leider kommt damit aber noch noch eine Konzentrationsabhängigkeit hinzu, die wir bei pH=7 nicht haben, weil da der Korrekturterm Null ist.
Auch dazu ein Beispiel: Nimm an, wir haben eine Zitronensäure und wollen sie auf pH=4.5 bringen. Die Anteile der vier Spezies sind unter diesen Bedingungen nach obiger Formel für x=10¯⁴·⁵ mol/l=0.00003162 mol/l folgendermaßen: 2.329%, 59.865%, 33.664% und 4.142%. Pro Mol Zitronensäure brauchen wir also 1.3962 mol NaOH.
Gleichzeitig muß die Lösung aber noch die notwendigen 0.00003162 mol/l H₃O⁺ enthalten, damit sie auch wirklich pH=4.5 hat. Wir müssen also pro Liter Lösung 0.00003162 mol NaOH weniger verwenden als berechnet (den Beitrag der OH¯ können wir vernachlässigen, weil bei pH=4.5 c(H₃O⁺)≫c(OH¯) ist).
- Nimm an, wir haben 1 l einer 1 mol/l Zitronensäurelösung und wollen sie auf pH=4.5 bringen. Dann schütten wir einfach 1.3962−0.00003162≈1.3962 mol NaOH dazu; die Korrektur spielt also keine Rolle.
- Aber jetzt wollen wir dasselbe für einen Liter 0.001 mol/l Zitronensäure. Wir brauchen also ein Tausendstel des obigen nämlich 0.0013962 mol NaOH für die Zitronensäure und ziehen davon 0.00003162 für den Liter ab, insgesamt macht das 0.0013646 mol NaOH, eine kleine aber merkliche Korrektur.
- Alternativ dasselbe: Wir lösen 1 mol Zitronensäure in 1000 l Wasser, dann brauchen wir 1.3962 mol NaOH für die Zitronensäure minus 0.03162 mol für die 1000 Liter, also 1.36456 mol NaOH insgesamt. Das ist also konsistent.
Es ist schon recht spät und ich hoffe, daß sich diese Geschichte einigermaßen verständlich und unfallfrei hingekriegt habe. Wenn nicht, dann frag nach. Ich werde es mir morgen auch noch einmal mit klarerem Kopf durchlesen und gegebenenfalls Fehler oder Verworrenheiten korrigieren.
P.S.: Vielleicht ist es auch instruktiv, das einmal für eine einbasige Säure durchzurechnen. Dann brauchen wir nur den Anteil der deprotonierten Form zu kennen, und unser knusprige Ausdruck von oben vereinfacht sich für n=1 und i=1 zu einem simplen Kₐ/(x+Kₐ). Für Essigsäure mit pKₐ=4.74 bzw. Kₐ=1.82⋅10¯⁵ mol/l bekommen wir bei pH=7 den Acetat-Anteil 99.45%; man muß also pro Mol Essigsäure 0.9945 mol NaOH zugeben, um bei pH=7 zu landen.
Bei pH=4 bzw. x=c(H₃O⁺)=0.0001 mol/l ist der Acetatanteil aber nur 15.395%; wir müssen zum Erreichen von pH=4 also nur 0.15395 mol NaOH zugeben, aber da kommt noch der Korrekturterm dazu:
- Für einen Liter 1 mol/l Essigsäure brauchen wir 0.15395−0.0001=0.15385 NaOH, der Korrekturterm stellt sicher, daß wir nachher auch wirklich 10¯⁴ mol/l H₃O⁺ in der Lösung haben.
- Für einen Liter 0.001 mol/l Essigsäure sind es dann 0.00015395−0.0001=0.0005395 mol NaOH. Der Korrekturterm macht dabei eine ganze Menge aus.





Dann ist die Frage ja vermutlich überdetailliert beantwortet, nochmals die Kurzform Ein Volumen V einer einbasigen Säure der Konzentration c₀ bekommst Du auf einen bestimmten pH durch Zugabe von
V [ c₀Kₐ/(10¯ᵖᴴ+Kₐ)−10¯ᵖᴴ+Kw/10¯ᵖᴴ ] mol NaOH,
und für den Ziel-pH 7 vereinfacht sich das zu
Vc₀Kₐ/(10¯ᵖᴴ+Kₐ) mol NaOH,
Denkfehler vorbehalten, deshalb immer Ableitung überprüfen.
Danke, mir ging es tatsächlich vorrangig um einbasige Säuren (was mit mehr als einbasigen Säuren ist muss ich nicht unbedingt für die anstehende Klausur wissen)