Kann mir jemand diese Aufgabe erklären?
hallo! Kann mir jemand diese Aufgabe erklären?

Lösung sollte sein: [NH3]=0,15mol/L [OH-]= 0,05mol/L [NH4+]5,4 *10^-5mol/L
1 Antwort

- Du hast n=cV=0.0675 mol NH₄⁺
- und n=cV=0.09 mol OH¯
- die zusammen in 450 ml Suppe leben.
Nun reagieren die beiden
NH₄⁺ + OH¯ ⟶ NH₃ + H₂O
- Da Ammonium im Unterschuß vorliegt, wird weitgehend alles NH₄⁺ zu NH₃ reagieren (darauf kommen wir später noch mal zurück), das macht also n=0.0675 mol NH₃ bzw. c=n/V=0.15 mol/l NH₃
- Von den OH¯ bleiben noch 0.0225 mol übrig, das macht c=n/V=0.05 mol/l.
Das war einfach, weil wir nur stöchiometrisch gerechnet haben. Für die NH₄⁺-Konzentration brauchen wir aber das Massenwirkungsgesetz, und da muß irgendeine Gleichgewichtskonstante gegeben sein, z.B. die Säurekonstante von Ammonium, pKₐ=9.25 oder etwas Äquivalentes. Dann schreiben wir das Massenwirkungsgesetz für die Säurereaktion des Ammoniaks auf und ersetzen c(H₃O⁺) durch c(OH¯), weil wir diese Konzentration schon kennen:
NH₄⁺ + H₂O ⟶ NH₃ + H₃O⁺
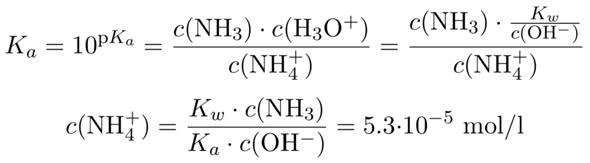
Du siehst, daß ich einen unwesentlich verschiedenen Wert für c(NH₄⁺) herausbekommen habe, vermutlich hat Deine Angabe einen leicht verschiedenen Wert für die Säurekonstante des Ammoniums.
Theoretisch müßten wir also den Zahlenwert für die Konzentration des NH₃, den wir oben als 0.15 mol/l herausbekommen haben, korrigieren, weil ja ein kleiner Anteil zu NH₄⁺ protoniert ist, aber dieser Anteil ist so klein, daß wir uns die Korrektur sparen können (es käme c(NH₃)=0.149947 heraus).
