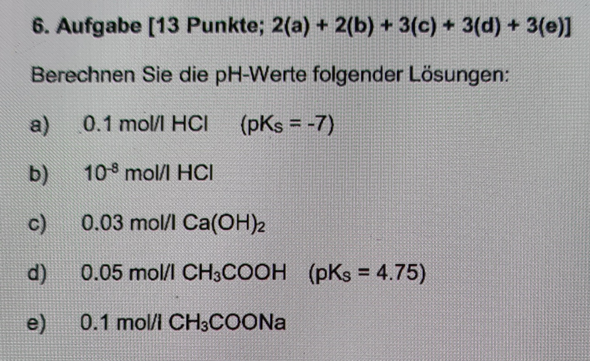
Nachdem die "Chemie 2"-Klausur erfolgreich gemeistert wurde (nicht zuletzt dank euer vielen hilfreichen Antworten), wird jetzt die "Chemie 1"-Klausur in Angiff genommen.
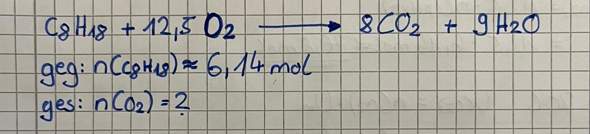
Es soll die Bildungsenthalpie von Methan mit hilfen folgender Reaktionsgleichungen und Reaktionsenthalpien berechnet werden.
Problem. Ich verstehe die Lösung nicht.
Δ Hf = -ΔH1 + ΔH2 + 2 ΔH3 würe ja bedeuten man nähme das umgedrehte ΔH1, addiert dazu ΔH2 und das zweifache von ΔH3.
ΔH1 umgedreht wäre -ΔH1: CO2 + 2 H20 -> CH4 + 2 O2
ΔH2 bleibt so wie's ist: C + O2 -> CO2
Und ΔH3 wird verdoppelt also: 2 * (H2 + 1/2 O2 -> H20) = 2 H2 + O2 -> 2 H 20.
So, wenn ich jetzt -ΔH1 + ΔH2 + 2ΔH3 rechne würde da stehen
CO2 + 2 H20 + C + O2 + 2 H2 + O2 -> CH4 + 2 O2 + CO2 + 2 H20
So, jetzt könnte man noch das 2 H20 auf beiden Seiten wegkürzen:
CO2 + C + O2 + 2 H2 + O2 -> CH4 + 2 O2 + CO2
Jetzt könnte man noch das O2 mit | - O2 auf die andere Seite bringen.
CO2 + C + 2 H2 + O2 -> CH4 + O2 + CO2
Aber das bringt uns ja nichts, weil da soll ja am Ende CH4 + 2O2 -> CO2 + 2 H20 rauskommen und nicht CO2 + C + 2 H2 + O2 -> CH4 + O2 + CO2.
Ich komm also nicht weiter.
ChatGPT schlgät vor CH4 in C + 4 H2O zu zerlegen - da weiß ich aber auch nicht ob das so möglich ist.
Kann jemand bisschen Licht ins Dunkle bringen?
Mit freundlichen Grüßen,
JensErkunde8.1